Слайд 2План.
1. Влияние различных факторов
2.Удельная адсорбция.
3. Смачивание.
4. Ионообменная адсорбция.
5. Значение адсорбции.

Слайд 3Влияние различных факторов
Количество поглощённого вещества зависит от
природы самого вещества (адсорбтива);
природы адсорбента;
давления газа

(или концентрации раствора);
температуры.
Слайд 4Удельная адсорбция.
Количественной характеристикой адсорбции является удельная адсорбция – количество вещества, поглощённое

с 1 см2 поверхности (или 1г массы)
Гуд = n1-n2 /S = x/S (моль/см2 или моль /м2)
Или Гуд = x/m (моль/г или моль /кг),
Где n1-исходное количество вещества газа; n2 – конечное количество вещества газа; S – поверхность адсорбента; x – число молей адсорбированного вещества; Гуд – удельная адсорбция; m – масса адсорбента, г
Слайд 5Удельная адсорбция.
Адсорбция веществ зависит от давления (для газов) и концентрации (для

растворённых веществ).
Слайд 6Удельная адсорбция.
Графически это отображается изотермой адсорбции.
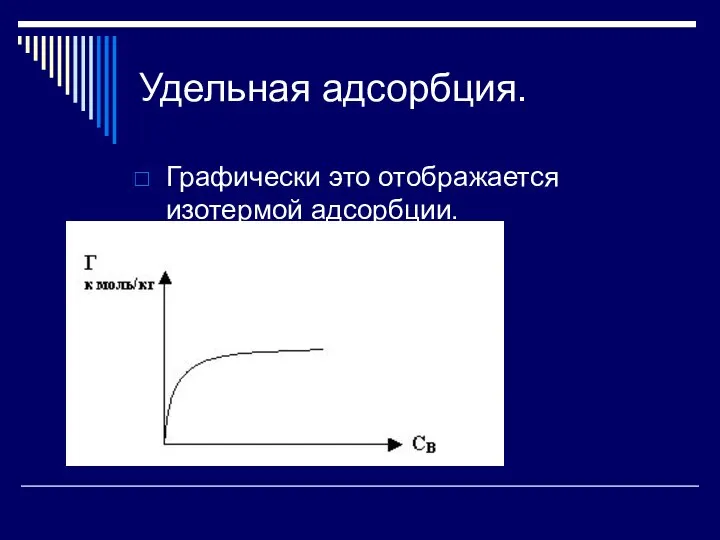
Слайд 7Изотерма адсорбции
Изотерма обычно состоит из трех участков. При малых давлениях изотерма прямолинейна,

т. е. адсорбция возрастает пропорционально равновесному давлению. При достаточно больших давлениях изотерма имеет вид горизонтальной прямой, т. е. с увеличением давления адсорбция не изменяется. Это предел адсорбции, отвечающий полному насыщению поверхности адсорбента молекулами адсорбтива. Средний участок изотермы соответствует какому-то неполному насыщению поверхности. Предел адсорбции не зависит от температуры и при более высокой температуре он наступает при более высоком равновесном давлении.
Слайд 8Удельная адсорбция.
Адсорбция из растворов имеет существенные отличия от газовой адсорбции. Это вызвано

следующими причинами:
на адсорбенте может адсорбироваться не только растворенное вещество, но и сам растворитель. Чем лучше протекает адсорбция растворителя, тем труднее будет адсорбироваться растворенное вещество;
растворитель может растворять адсорбент. Чем лучше растворитель растворяет адсорбент, тем труднее протекает на нём адсорбция;
скорость адсорбции из раствора зависит от скорости диффузии.
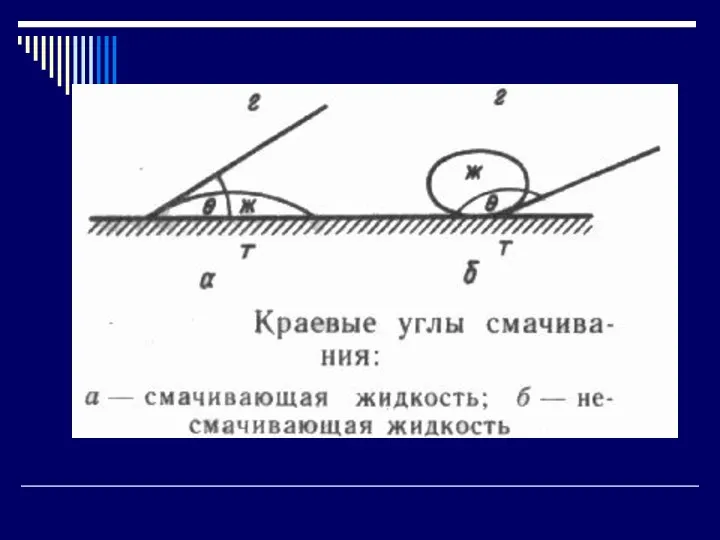
Слайд 9Смачивание.
Твёрдые поверхности, смачиваемые водой, называются гидрофильными. Капля воды растекается по такой поверхности

или образует с ними острый краевой угол.
Поверхности, на которых вода не растекается и образует тупой краевой угол, называются гидрофобными.
Слайд 11Смачивание.
Адсорбция растворённых веществ твёрдыми адсорбентами подчиняется одному общему правилу: чем лучше данный

растворитель смачивает поверхность адсорбента, тем меньше адсорбция молекул растворённого вещества из данного растворителя на этой поверхности, и наоборот, если растворитель плохо смачивает данную твёрдую поверхность, то адсорбция молекул растворённого вещества на ней будет велика.
Слайд 12Ионообменная адсорбция.
Ионная адсорбция – это адсорбция ионов, содержащихся в растворах электролитов.

Часто ионная адсорбция протекает необратимо. С повышением температуры она нередко возрастает.
Иногда ионная адсорбция сопровождается ионным обменом. К ионному обмену способны некоторые природные алюмосиликаты, а также получаемые искусственно ионообменные смолы, или иониты.










 Органическая химия. Классификация. Номенклатура
Органическая химия. Классификация. Номенклатура Номенклатура органических соединений. Упражнения
Номенклатура органических соединений. Упражнения Ковалентная полярная связь
Ковалентная полярная связь Алюминий и сплавы алюминия
Алюминий и сплавы алюминия Физический этап развития периодического закона
Физический этап развития периодического закона a319f492a6071afff03d7efc722c906b
a319f492a6071afff03d7efc722c906b Первоначальные химические понятия
Первоначальные химические понятия Диеновые углеводороды. Алкадиены
Диеновые углеводороды. Алкадиены Алканы
Алканы Медь и ее сплавы
Медь и ее сплавы Классификация силикатов
Классификация силикатов День химии
День химии Аминокислоты. Пептиды. Белки. Тема 2
Аминокислоты. Пептиды. Белки. Тема 2 Металлы - наши друзья или враги
Металлы - наши друзья или враги Решение расчетных задач
Решение расчетных задач Теория электролитической диссоциации
Теория электролитической диссоциации Силумины. Виды силуминов
Силумины. Виды силуминов Пористые стекла
Пористые стекла Масс-спектрометрия шерсти волка обыкновенного Canis lupus
Масс-спектрометрия шерсти волка обыкновенного Canis lupus Звездный час по химии
Звездный час по химии Ионная полимеризация
Ионная полимеризация Повторение по теме Химические реакции
Повторение по теме Химические реакции Химия - неотъемлемая часть жизни
Химия - неотъемлемая часть жизни Мастер - класс: Окислительно-восстановительные реакции
Мастер - класс: Окислительно-восстановительные реакции Взаимодействие карбонатов с разбавленными кислотами. Качественные реакции на карбонаты
Взаимодействие карбонатов с разбавленными кислотами. Качественные реакции на карбонаты Получение и реакции пиразина
Получение и реакции пиразина Алюминий. Из истории открытия
Алюминий. Из истории открытия Бораны и карбораны
Бораны и карбораны