Содержание
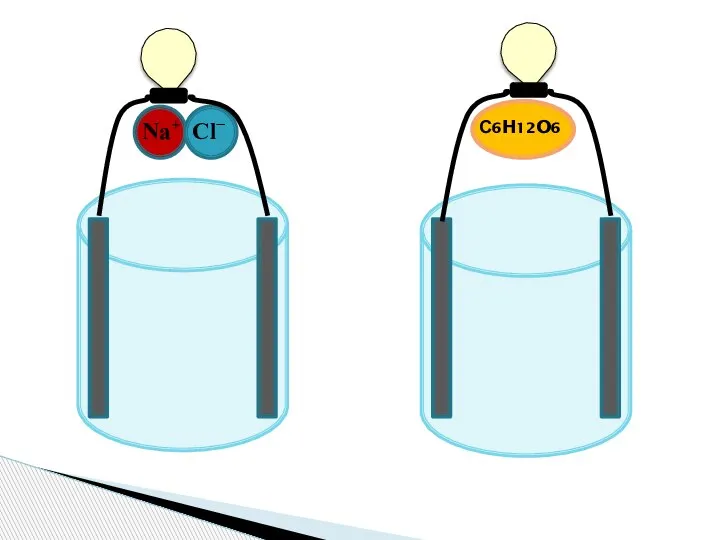
- 2. Na+ Cl− С6H12O6
- 3. Ток - направленное движение заряженных частиц Заряженные частицы - ионы Распад вещества на ионы - диссоциация
- 6. СУЩНОСТЬ ПРОЦЕССА ДИССОЦИАЦИИ 1.Ориентация молекул воды вокруг растворяемого вещества 2.Гидратация (соединение) молекул воды с противоположно заряженными
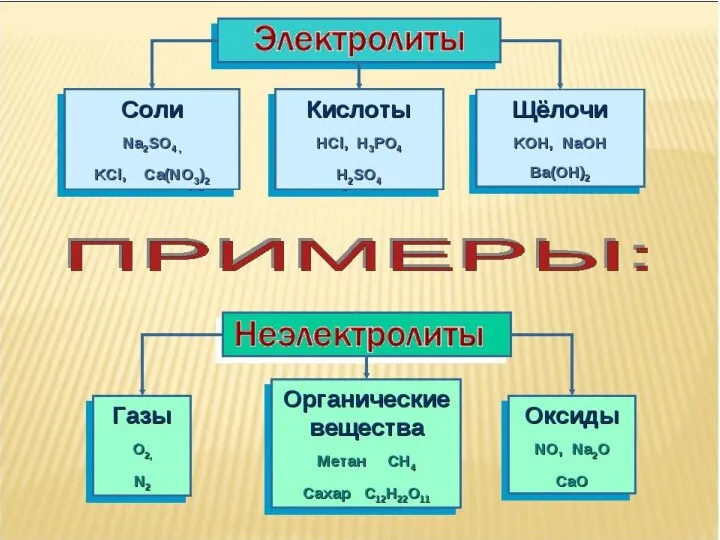
- 7. Различают три типа электролитов: 1.Основания (щелочи) – диссоциируют в растворе на катионы металлов и анионы гидроксогрупп.
- 8. ДОМАШНЕЕ ЗАДАНИЕ Запишите диссоциацию водных растворов: HNO3, K2S, Cr2(SO4)3, LiOH, BaSO4, FeCl3, Ca(OH)2, Cu(OH)2
- 10. Скачать презентацию





 Карбоновые кислоты
Карбоновые кислоты Водород
Водород Вода и классы химических веществ
Вода и классы химических веществ Химическая технология. Структура ВКР
Химическая технология. Структура ВКР Химический состав клетки. Неорганические вещества
Химический состав клетки. Неорганические вещества Классификация НПВС (по химической структуре активности)
Классификация НПВС (по химической структуре активности) Технические материалы. Металлические и неметаллические. (Тема 1)
Технические материалы. Металлические и неметаллические. (Тема 1) Презентация на тему Круговорот углерода в природе
Презентация на тему Круговорот углерода в природе  Нефть
Нефть Турнир знатоков химии. Химическая лихорадка
Турнир знатоков химии. Химическая лихорадка VI A Grupas elementi
VI A Grupas elementi Степень окисления. Составление химических формул бинарных соединений
Степень окисления. Составление химических формул бинарных соединений Взаимодействие металлов с водой, щелочами, кислотами, солями, простыми веществами
Взаимодействие металлов с водой, щелочами, кислотами, солями, простыми веществами Химическое расследование. Химические свойства галогенов
Химическое расследование. Химические свойства галогенов Астат. Свойства астата
Астат. Свойства астата Спирты. Классификация
Спирты. Классификация Алкены-3
Алкены-3 Металлы общая характеристика
Металлы общая характеристика Положение об осуществлении контроля за внешнеэкономической деятельностью в отношении химикатов, оборудования и технологий
Положение об осуществлении контроля за внешнеэкономической деятельностью в отношении химикатов, оборудования и технологий електроліти та неелектроліти
електроліти та неелектроліти Элементарный химический состав белков
Элементарный химический состав белков Натуральный каучук
Натуральный каучук Углерод
Углерод 01. Химический состав
01. Химический состав Презентация на тему Типы химических реакций
Презентация на тему Типы химических реакций  Презентация по химии. Спирты, их свойства и применение.
Презентация по химии. Спирты, их свойства и применение. Презентация на тему Гидролиз солей
Презентация на тему Гидролиз солей  Химическое равновесие
Химическое равновесие