Содержание
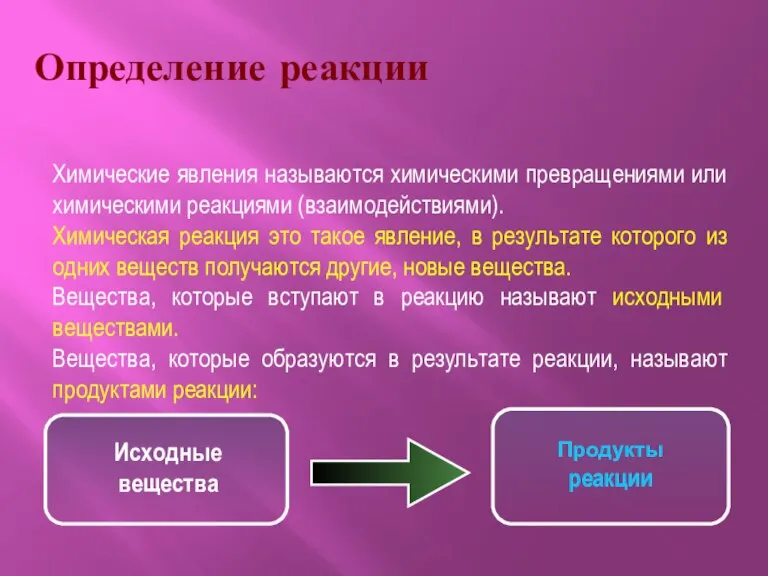
- 2. Определение реакции Химические явления называются химическими превращениями или химическими реакциями (взаимодействиями). Химическая реакция это такое явление,
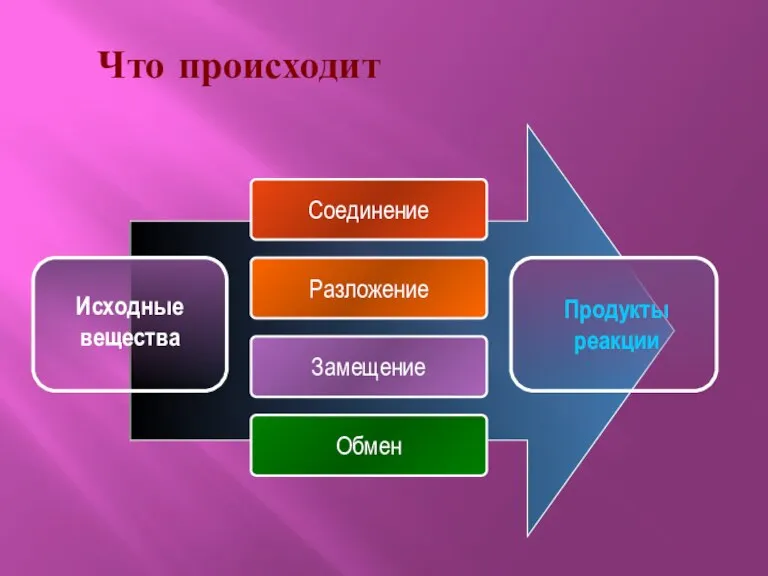
- 3. Что происходит Соединение Разложение Замещение Обмен Продукты реакции Исходные вещества
- 4. Типы реакций Реакция соединения Реакция разложения Реакция замещения Реакция обмена
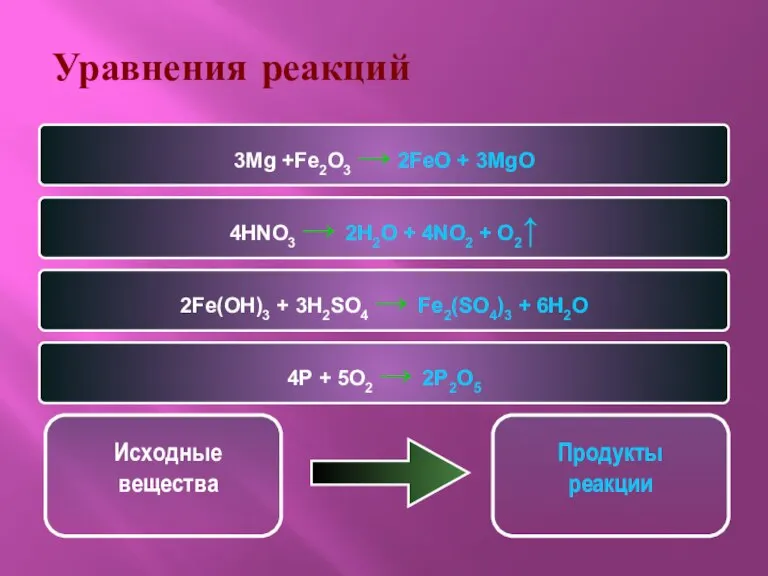
- 5. Уравнения реакций 3Mg +Fe2O3 → 2FeO + 3MgO 4HNO3 → 2H2O + 4NO2 + O2↑ 2Fe(OH)3
- 6. Признаки реакции 1.Выпадение или растворение осадка 2.Выделение или поглощение газа (запаха) 3.Изменение цвета (окраски) вещества 4.Повышение
- 7. Условия протекания Измельчение веществ Смешивание веществ Нагревание смеси
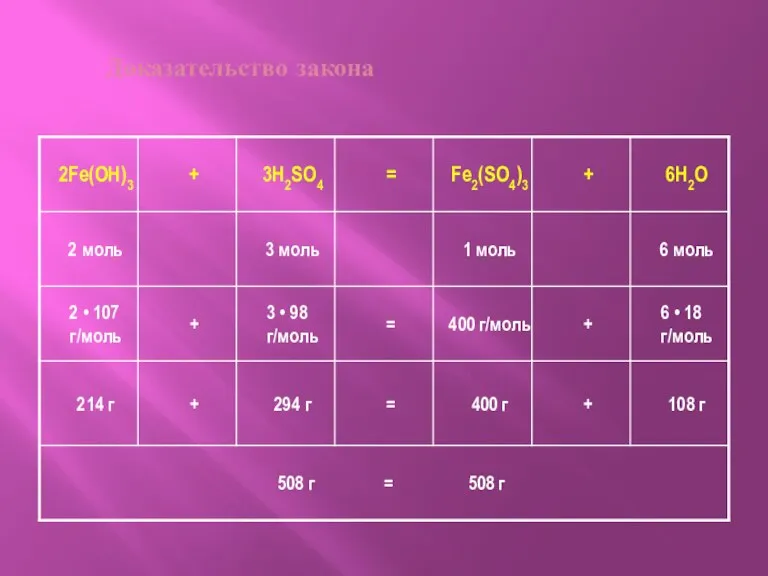
- 8. Закон сохранения массы
- 9. Доказательство закона
- 10. Реакция соединения A + B = AB A +B + C = ABC AB + C
- 11. Пример реакции соединения Горение стальной проволоки в колбе с кислородом: 3Fe + 2O2 = Fe3O4 +
- 12. Укажите правильное уравнение 2Na + O2 = 2Na2O 4NO2 + 2H2O + O2 = 4HNO3 2SO2
- 13. Реакция разложения AB = A +B ABC = A + B + C ABC = AB
- 14. Пример реакции разложения Разложение кислородсодержащего отбеливателя «Персоль» при нагревании: 2H2O2 + Q кДж → 2H2O +
- 15. Укажите правильное уравнение 2KClO3 → 2KCl + 3O2 ↑ 2CuCO3 → CuO + CO2 ↑ Fe(OH)3
- 16. Реакция замещения AB + C= CB +A ABC + D = DBC + A Математический алгоритм
- 17. Пример реакций замещения Взаимодействие цинка с соляной кислотой выражается уравнением: Zn + 2HCl = H2↑ +
- 18. Укажите правильное уравнение Mg + MnO2 = Mn + MgO + Q кДж 3Mg + H3PO4
- 19. Реакция обмена AB + CD = CB + AD Математический алгоритм Реакция обмена это такая реакция,
- 20. Пример реакции обмена Взаимодействие двух веществ, находящихся в растворённом виде – гидроксида калия и сульфата железа
- 21. Укажите правильные уравнения CuSO4 + 2KOH = Cu(OH)2↓ + K2SO4 H3PO4 + KOH = K3PO4 +
- 22. Повторим ещё раз: Химическая реакция – … Химическое уравнение – … Типы химических реакций … Признаки
- 23. Задания для успешных Тест №1: химическая реакция Тест №2: химическое уравнение Тест №3: типы химических реакций
- 24. Урок окончен, спасибо!
- 25. Это правильный ответ! Отлично! Так держать! обратно
- 26. Это правильный ответ! Отлично! Так держать! обратно
- 27. Это правильный ответ! Отлично! Так держать! обратно
- 28. Это правильный ответ! Отлично! Так держать! обратно
- 29. Это неверный ответ! Подумай ещё! обратно
- 30. Это неверный ответ! Подумай ещё! обратно
- 31. Это неверный ответ! Подумай ещё! обратно
- 33. Скачать презентацию


























 Химическая кинетика
Химическая кинетика Растворение. Растворимость веществ в воде
Растворение. Растворимость веществ в воде Кислотно-основное равновесие
Кислотно-основное равновесие Тест по теме Основные классы неорганических соединений
Тест по теме Основные классы неорганических соединений Физическая химия поверхностных явлений
Физическая химия поверхностных явлений Электролитическая диссоциация кислот
Электролитическая диссоциация кислот 11 класс 15.09
11 класс 15.09 Степень окисления серы
Степень окисления серы Виды работ на уроках химии
Виды работ на уроках химии Презентация на тему Металлическая связь
Презентация на тему Металлическая связь  Действие активированного угля
Действие активированного угля Презентация на тему Твердые вещества
Презентация на тему Твердые вещества  Органическая химия
Органическая химия Природные смолы: мирра, ладан и шеллак
Природные смолы: мирра, ладан и шеллак Положение металлов в периодической системе Д.И. Менделеева и особенности строения их атомов
Положение металлов в периодической системе Д.И. Менделеева и особенности строения их атомов Валентность
Валентность Карбоновые кислоты
Карбоновые кислоты Обобщение знаний по курсу органической химии
Обобщение знаний по курсу органической химии Кислород и сера. Их положение в ПСХЭ. Значение и применение
Кислород и сера. Их положение в ПСХЭ. Значение и применение 20140111_mineraly
20140111_mineraly Кислоты
Кислоты Арены. Ароматические углеводороды
Арены. Ароматические углеводороды Презентация на тему Химические свойства многоатомных спиртов
Презентация на тему Химические свойства многоатомных спиртов  Генетичні зв’язки між неорганічними речовинами
Генетичні зв’язки між неорганічними речовинами Многообразие веществ
Многообразие веществ Калийные удобрения. Лекция 28
Калийные удобрения. Лекция 28 Простагландины. Воздействие фосфолипаз на фосфолипид
Простагландины. Воздействие фосфолипаз на фосфолипид Химия углеводов
Химия углеводов