Содержание
- 2. В настоящее время мы являемся свидетелями разрушения архитектурных сооружений и конструкций. От кислотных дождей катастрофически страдают
- 3. Слово коррозия происходит от латинского corrodere, что означает разъедать. Коррозией называют самопроизвольный процесс разрушения материалов и
- 4. КОРРОЗИЯ - РЖАВАЯ КРЫСА, ГРЫЗЕТ МЕТАЛЛИЧЕСКИЙ ЛОМ, В ШЕФНЕР 4Fe + 6H2O + 3O2 = 4Fe(OH)3
- 5. Виды коррозии Химическая Электрохимическая
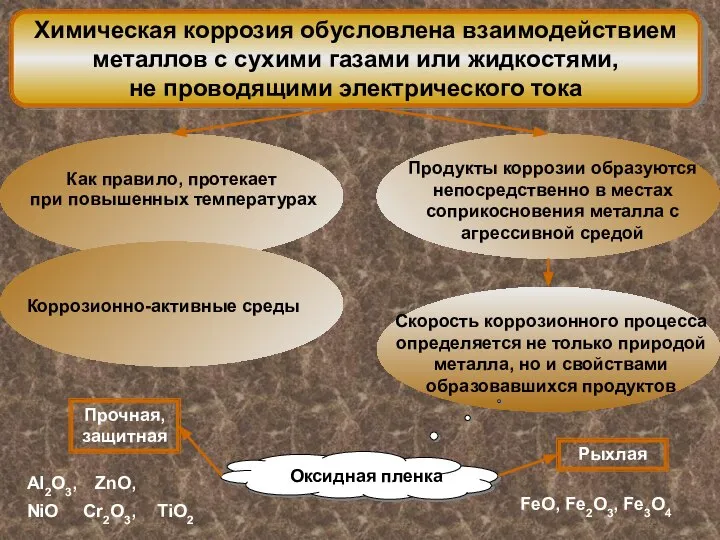
- 6. Химическая коррозия обусловлена взаимодействием металлов с сухими газами или жидкостями, не проводящими электрического тока Прочная, защитная
- 7. Электрохимическая коррозия осуществляется за счет электрохимических реакций, происходящих на поверхности металла, находящегося в контакте с раствором
- 9. Электрохимический ряд напряжений металлов Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Ni,
- 10. Коррозия металлов СПЛОШНАЯ МЕСТНАЯ не представляет особой опасности для конструкций и аппаратов особенно в тех случаях,
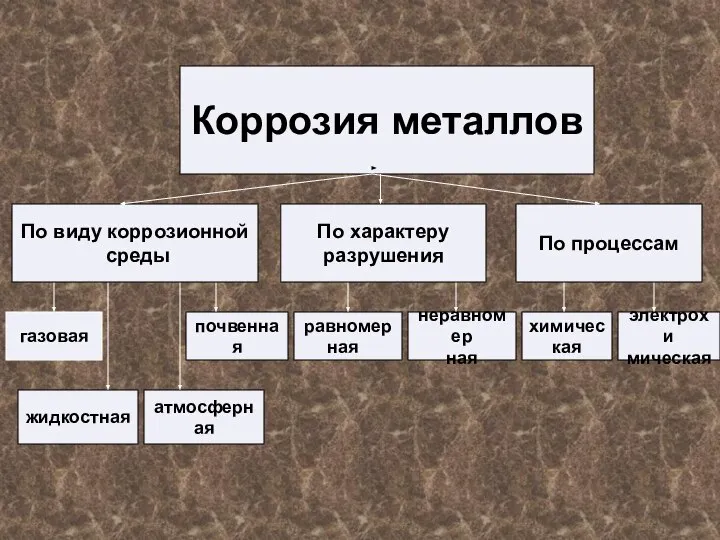
- 11. Коррозия металлов
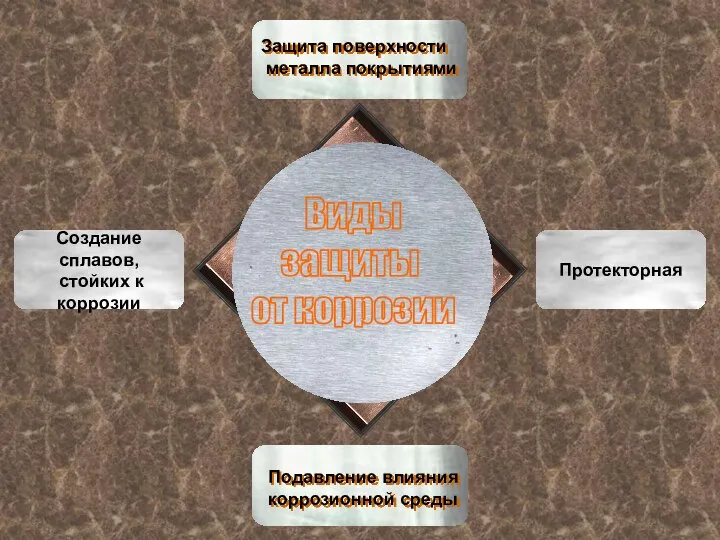
- 12. Виды защиты от коррозии Протекторная Создание сплавов, стойких к коррозии Защита поверхности металла покрытиями Подавление влияния
- 16. Скачать презентацию










 Презентация на тему Что такое нано?
Презентация на тему Что такое нано? 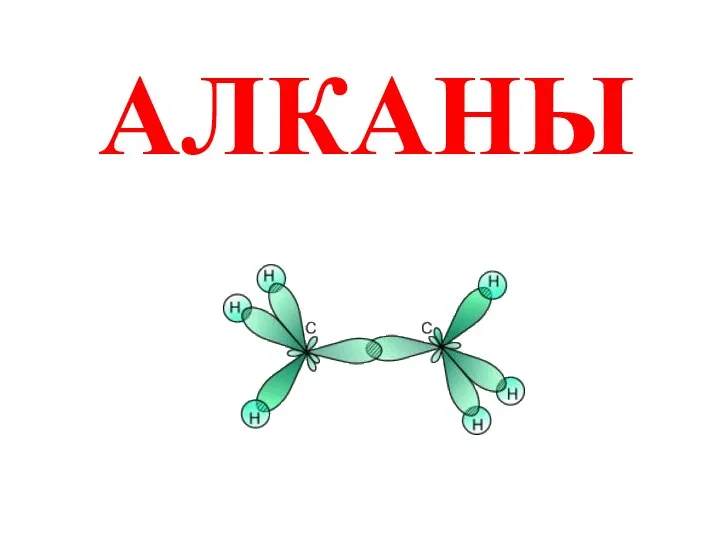 Алканы
Алканы Сложные эфиры. Содержание. Определение
Сложные эфиры. Содержание. Определение Основные понятия химической термодинамики
Основные понятия химической термодинамики Химические элементы, входящие в состав питательных веществ
Химические элементы, входящие в состав питательных веществ Получение металлов
Получение металлов Сера
Сера Углеводороды. Характеристика
Углеводороды. Характеристика alkany_stroenie_nomenklatura_izomeriya_10_klass (3)-1
alkany_stroenie_nomenklatura_izomeriya_10_klass (3)-1 Все свойства минералов
Все свойства минералов Коррозионные диаграммы
Коррозионные диаграммы Синтетические органические соединения
Синтетические органические соединения Строение атома
Строение атома Сера и его соединения
Сера и его соединения Алкины
Алкины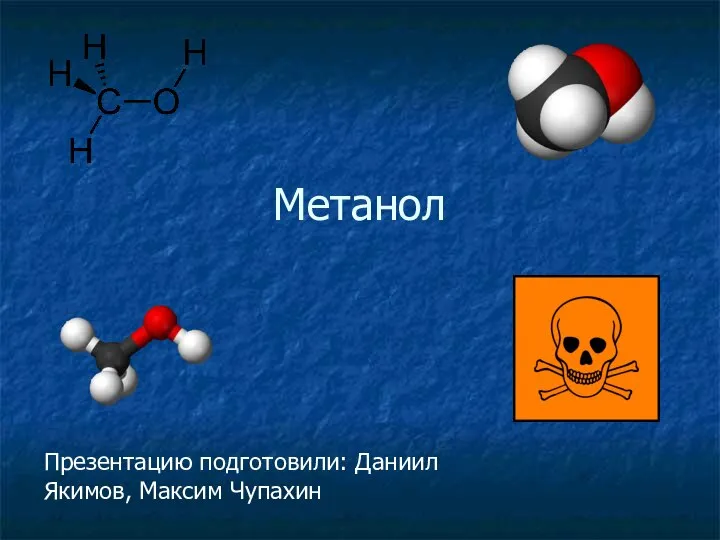 Метанол. Краткая характеристика
Метанол. Краткая характеристика Периодический закон Менделеева в действии
Периодический закон Менделеева в действии Предмет органической химии
Предмет органической химии Химия в быту
Химия в быту Химия природная или синтетическая. За и против
Химия природная или синтетическая. За и против Химическая связь в твердых телах. Экзаменационные вопросы
Химическая связь в твердых телах. Экзаменационные вопросы Окислительно-восстановительные реакции. 8 класс
Окислительно-восстановительные реакции. 8 класс Поверхность потенциальной энергии и расчет сил, действующих на ионы
Поверхность потенциальной энергии и расчет сил, действующих на ионы Вывод формул веществ по известным массовым долям элементов
Вывод формул веществ по известным массовым долям элементов Гипер-гипофосфатемия
Гипер-гипофосфатемия Презентация на тему Углерод
Презентация на тему Углерод  Соединения железа
Соединения железа Чистые вещества и смеси. Классификация веществ. Оксиды
Чистые вещества и смеси. Классификация веществ. Оксиды