Содержание
- 2. «Атом» – неделимый, введено в лексикон греческим философом Демокритом -2500 лет назад.
- 3. Модель атома Томсона Джозеф Джон Томсон (1856 – 1940) Атом представляет собой непрерывно заряженный положительным зарядом
- 4. Модель атома Резерфорда Эрнест Резерфорд (1871 – 1937) Экспериментально иссле-довал распределение поло-жительного заряда. В 1911 г.
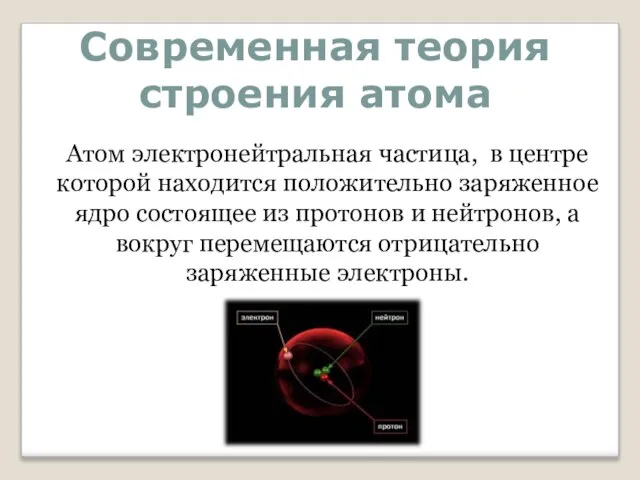
- 5. Современная теория строения атома Атом электронейтральная частица, в центре которой находится положительно заряженное ядро состоящее из
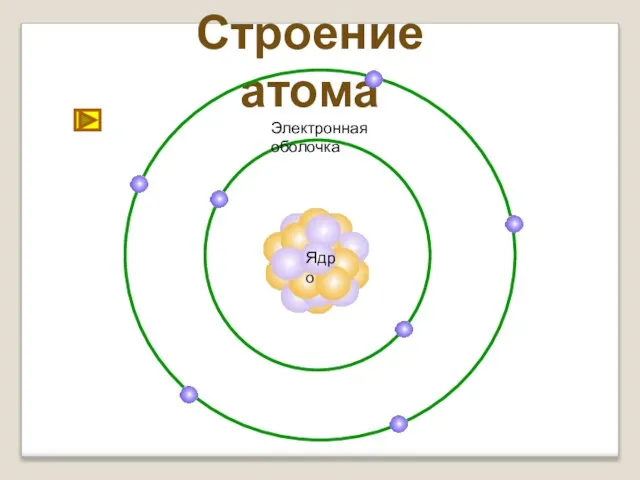
- 6. Строение атома Ядро Электронная оболочка
- 7. Элементарные частицы
- 8. Генри Мозли (Англия, 1914г.) исследовал изменения зарядов ядер по П.С. На основании его работ выяснилась важная
- 9. Расчет элементарных частиц в атоме Число протонов + число нейтронов = массовое число, т.е. Z +
- 10. Разновидности атомов
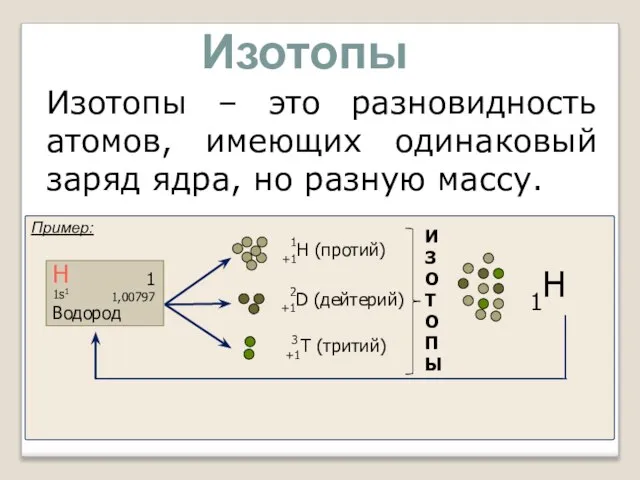
- 11. Изотопы – это разновидность атомов, имеющих одинаковый заряд ядра, но разную массу. Изотопы
- 12. Химический элемент – это совокупность атомов с одинаковым зарядом ядра.
- 14. Скачать презентацию








 Количество вещества. Решение задач
Количество вещества. Решение задач Ионообменная хроматография в разделении белков
Ионообменная хроматография в разделении белков Неметаллы. Агрегатные состояния неметаллов
Неметаллы. Агрегатные состояния неметаллов Устойчивость коллоидных лиофобных дисперсных систем. Теория ДЛФО. Лекция 14
Устойчивость коллоидных лиофобных дисперсных систем. Теория ДЛФО. Лекция 14 Сравнение активностей металлов
Сравнение активностей металлов Кремнийорганическая гипотеза
Кремнийорганическая гипотеза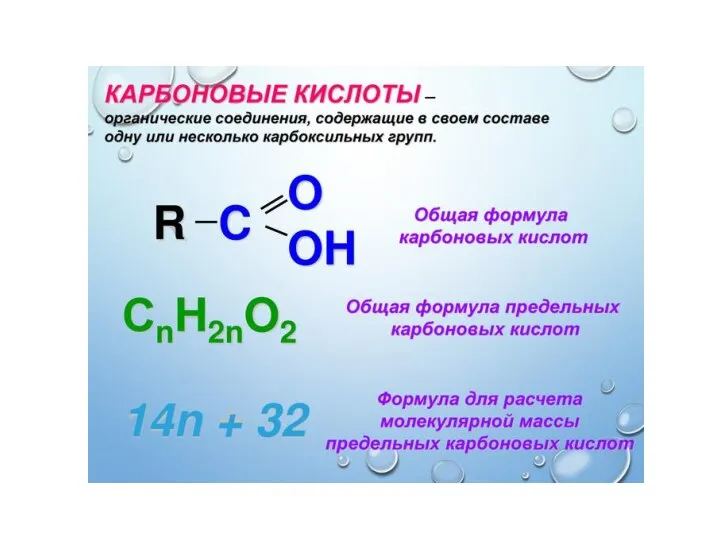 Карбоновые кислоты
Карбоновые кислоты Гидроксиды металлов
Гидроксиды металлов Методические рекомендации по преподаванию учебного предмета Химия в 2021-2022 учебном году
Методические рекомендации по преподаванию учебного предмета Химия в 2021-2022 учебном году Химический диктант по органической химии. 9 класс
Химический диктант по органической химии. 9 класс Изучение адсорбции аминокислот на поверхности гидроксилапатита при варьировании рН
Изучение адсорбции аминокислот на поверхности гидроксилапатита при варьировании рН Презентация на тему Карбоновые кислоты
Презентация на тему Карбоновые кислоты  Простые вещества – металлы и неметаллы
Простые вещества – металлы и неметаллы Общие физические и химические свойства металлов. 9 класс
Общие физические и химические свойства металлов. 9 класс Важнейшие соединения хлора
Важнейшие соединения хлора Неметаллы и их соединения
Неметаллы и их соединения Расчеты по химическим уравнениям
Расчеты по химическим уравнениям Углеводы. Дисахариды. Полисахариды. Лекция 6
Углеводы. Дисахариды. Полисахариды. Лекция 6 Химия и жизнь
Химия и жизнь Тяжелая вода
Тяжелая вода География. Уральские самоцветы
География. Уральские самоцветы Активность каталазы
Активность каталазы Общие вопросы материаловедения
Общие вопросы материаловедения Химические явления. Горение. Презентация по природоведению для 5 класса Подготовила Шашлова Т.А.
Химические явления. Горение. Презентация по природоведению для 5 класса Подготовила Шашлова Т.А. Основания, их классификация и свойства
Основания, их классификация и свойства Дизельное топливо
Дизельное топливо електроліти та неелектроліти
електроліти та неелектроліти Составление уравнений химических реакций. Решение упражнений по теме
Составление уравнений химических реакций. Решение упражнений по теме