Содержание
- 2. Содержание Введение Требования к студентам Учебная информация: АФО органов дыхания. Объективное обследование органов дыхания. Пальпация грудной
- 3. Цели занятия Назад Учебная: добиться прочного усвоения системы знаний, сформировать умение объяснять факты на основе причинно-следственных
- 4. Требования к студентам Назад После изучения темы «Галогены» студент должен знать: общую характеристику элементов VIIА группы,
- 5. Актуальность Назад Галогены и их соединения играют важную роль в организме человека, в медицине и фармации.
- 6. Соединения галогенов с водородом Из соединений с неметаллами наибольшее практическое значение имеют галогеноводороды HF, HCl, HBr
- 7. Соединения галогенов с водородом (продолжение) HF, HCl, HBr, HI Прочность химической связи падает, так как уменьшается
- 8. Соединения галогенов с водородом (продолжение) Химические свойства галогеноводородов Сухие галогеноводороды не действуют на большинство металлов. 2)
- 9. Соединения галогенов с водородом (продолжение) Отрицательные ионы галогенов – восстановители. Исключение – фторид-ион, т.е. плавиковая кислота
- 10. Соединения галогенов с водородом (продолжение) I. Получение HF из плавикового шпата: CaF2+H2SO4→CaSO2+2HF Получение HCl 1) Сжигание
- 11. Соединения галогенов с водородом (продолжение) HCl – бесцветный газ с резким запахом, на воздухе при соприкосновении
- 12. Соединения галогенов с водородом (продолжение) Разбавленная кислота (массовая доля 4% и менее) запаха почти не имеет,
- 13. Соединения галогенов с водородом (продолжение) III. Получение HBr и HI. Восстановительные свойства HBr и HI проявляются
- 14. Соединения галогенов с водородом (продолжение) HBr – бесцветный газ с резким запахом, «дымит» на воздухе. При
- 15. Соединения галогенов с неметаллами Большинство соединений галогенов с неметаллами имеют молекулярную структуру и представляют собой газы,
- 16. Соединения галогенов с металлами Для получения соединений галогенов с металлами, т.е. солей, применяют как реакции соединения,
- 17. Фториды Фториды неметаллов гидролизуются в небольшой степени. Большинство фторидов труднорастворимы в воде, хорошо растворимы фториды натрия,
- 18. Хлориды Получение хлоридов Непосредственное взаимодействие металла с хлором Fe + 3Cl2 → 2FeCl3 2) Взаимодействием соляной
- 19. Хлориды (продолжение) Натрия хлорид – поваренная соль. Na+ и Cl- - главные ионы жидкостей человеческого организма.
- 20. Хлориды (продолжение) Калия хлорид – KCl. Применение: в качестве удобрения в с\х получение гидроксида калия Кальция
- 21. Хлориды (продолжение) Ртути дихлорид - HgCl2 - сулема. Очень ЯДОВИТОЕ вещество. Ранее применялись водные растворы сулемы
- 22. Хлориды (продолжение) Ртути дихлорид - HgCl2 - сулема. Регистрация препарата ртути дихлорид (сулема) для медицинских целей
- 23. Хлориды (продолжение) Ртути монохлорид - Hg2Cl2 - каломель. Менее ядовитое соединение. Получают нагреванием смеси металлической ртути
- 24. Хлориды (продолжение) Серебра хлорид – AgCl Применение: Примененяется как светочувствительное вещество при изготовлении фотопленок, что основано
- 25. Хлориды (продолжение) Натрия бромид и калия бромид NaBr, KBr, NH4Br Применение в медицине: успокаивающие средства, нормализуют
- 26. Хлориды (окончание) Натрия йодид – NaI Тело человека содержит около 25 мг йода, из которых примерно
- 27. Калия йодид - KI Получение FeI2 + I2 + 6KOH → 6KI + Fe2O3 + 3H2O
- 28. Распознавание галогеноводородных кислот и их солей Нитрат серебра в присутствии HNO3(разб) осаждает из растворов осадки солей
- 29. Распознавание галогеноводородных кислот и их солей Хлорид серебра – белый творожистый осадок, нерастворимы в воде и
- 30. Распознавание галогеноводородных кислот и их солей (окончание) Назад Для открытия бромид- и иодид-ионов используют их способность
- 31. Кислородные соединения галогенов Назад При взаимодействии хлора с водой образуются соляная и хлорноватистая кислоты: Сl2+H2O↔HCl +
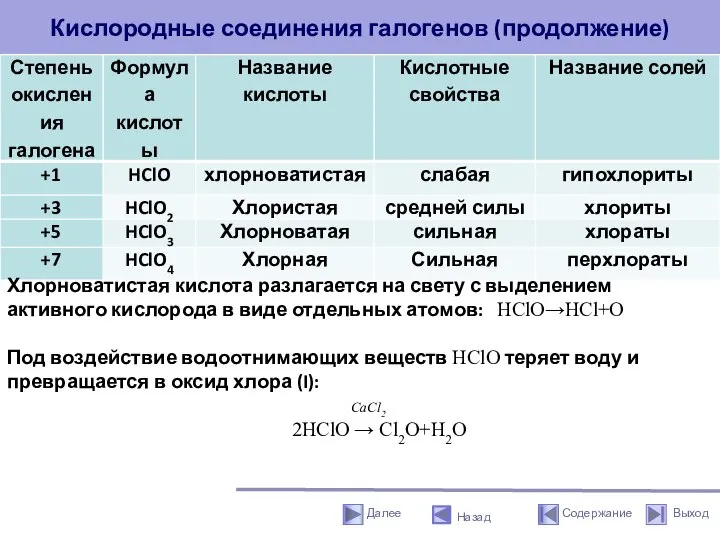
- 32. Кислородные соединения галогенов (продолжение) Хлор образует 4 кислородсодержащие кислоты Оксокислоты: Хлорная – НСlO4 Сl2O7 Хлорноватая –
- 33. Кислородные соединения галогенов (продолжение) Назад Хлорноватистая кислота разлагается на свету с выделением активного кислорода в виде
- 34. Кислородные соединения галогенов (продолжение) Хлор реагирует с растворами щелочей, подвергаясь полному диспропорционированию: 0 200C -1 +1
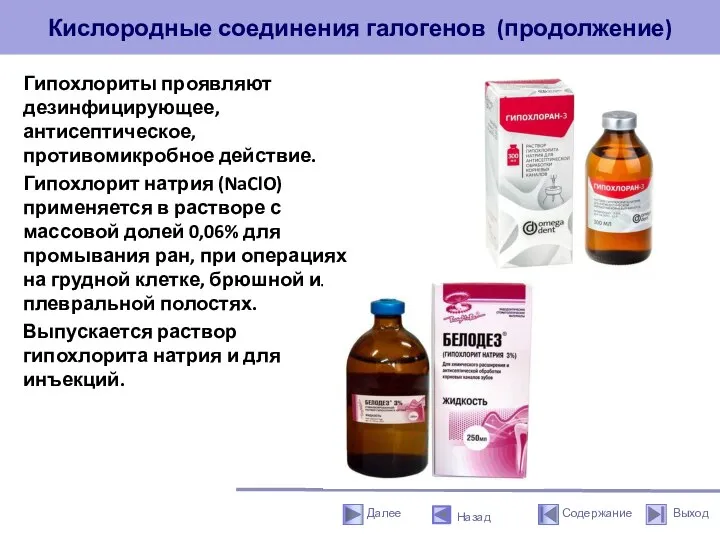
- 35. Кислородные соединения галогенов (продолжение) Гипохлориты проявляют дезинфицирующее, антисептическое, противомикробное действие. Гипохлорит натрия (NaClO) применяется в растворе
- 36. Кислородные соединения галогенов (продолжение) Назад Кислородосодержащие соли проявляют окислительные свойства, легко разлагаются. При обычной температуре окислительные
- 37. Кислородные соединения галогенов (окончание) Для бертолетовой соли и других кислородосодержащих солей характерно окислительное действие в твердых
- 38. Литература Назад Бабков А.В. Химия: учебник для студ. сред. мед. учеб. заведений -М.: издательский центр «Академия»,
- 40. Скачать презентацию


































 Определение формул органических веществ. Задачи для самостоятельного решения
Определение формул органических веществ. Задачи для самостоятельного решения Алкадиены: кумулированные, сопряженные, изолированные
Алкадиены: кумулированные, сопряженные, изолированные Классификация белков
Классификация белков Растворение. Растворимость веществ в воде
Растворение. Растворимость веществ в воде Аймақтық мета морфизм тауж ыныстары
Аймақтық мета морфизм тауж ыныстары Без золота прожить можно, без соли нельзя
Без золота прожить можно, без соли нельзя Теория электролитической диссоциации. Контрольный тест
Теория электролитической диссоциации. Контрольный тест каталитические системы на основе металлоценов и метилалюмоксана в реакциях непредельных соединений с изобутиланами
каталитические системы на основе металлоценов и метилалюмоксана в реакциях непредельных соединений с изобутиланами ЛК 2_окислительно-восстановительные процессы
ЛК 2_окислительно-восстановительные процессы Алкены. Пентен- С5Н10
Алкены. Пентен- С5Н10 Классы неорганических веществ. Игра для 9 класса
Классы неорганических веществ. Игра для 9 класса Нафта. Походження, переробка, використання
Нафта. Походження, переробка, використання Бөлу процестерінің тиімділігін бағалау әдістерін таңдау және таңдау принциптері
Бөлу процестерінің тиімділігін бағалау әдістерін таңдау және таңдау принциптері Разветвленные цепные реакции
Разветвленные цепные реакции Современные представления о строении атома
Современные представления о строении атома Презентация на тему Карбонаты
Презентация на тему Карбонаты  Сахароза. Физические и химические свойства
Сахароза. Физические и химические свойства Формула аспирина. Решение задач
Формула аспирина. Решение задач Основания, их классификация и свойства
Основания, их классификация и свойства Углеводы (Сахариды)
Углеводы (Сахариды) Кислоты в природе и дома. 8 класс
Кислоты в природе и дома. 8 класс Метилэтилкетон. Его применение и процесс получения
Метилэтилкетон. Его применение и процесс получения Углеводы (сахара). Строение, свойства, участие в функционировании живых систем
Углеводы (сахара). Строение, свойства, участие в функционировании живых систем Химическая кинетика и равновесие
Химическая кинетика и равновесие Составление химических формул методом нулевой суммы
Составление химических формул методом нулевой суммы Алканы. Этан
Алканы. Этан Композиційні матеріали на основі функціоналізованих олігодієнів, вінілових мономерів і наповнювачів різної природи
Композиційні матеріали на основі функціоналізованих олігодієнів, вінілових мономерів і наповнювачів різної природи Водорастворимые витамины. 7 свойств водорастворимых витаминов
Водорастворимые витамины. 7 свойств водорастворимых витаминов