Содержание
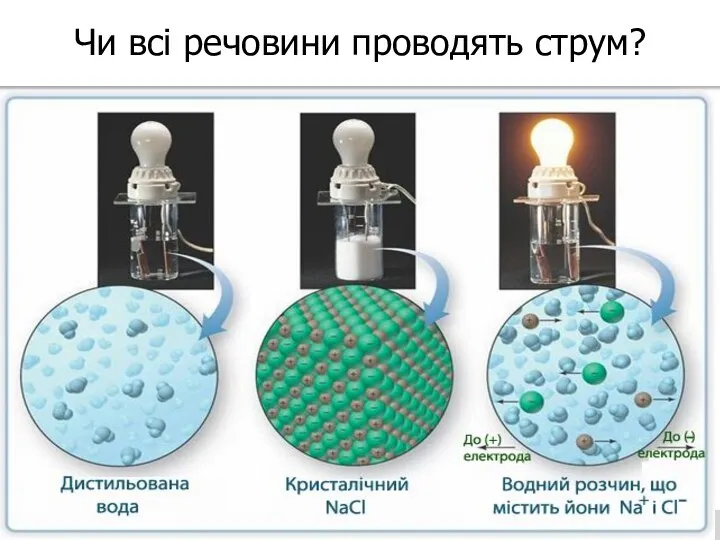
- 2. Чи всі речовини проводять струм?
- 3. Проблемне питання: Для чого потрібні речовини,які проводять електричний струм?
- 4. Тема: Електролітична дисоціація. Електроліти та неелектроліти. Урок хімії в 9 класі КЗ Верхівцевського НВК Учитель хімії
- 5. Мета: Дати відповідь на запитання: Чому одні речовини проводять струм, а інші - ні? Як їх
- 6. Цілі: Електролітична дисоціація. Електроліти та неелектроліти. ТЕД(теорія електролітичної дисоціації) Електролітична дисоціація кислот, основ, солей у водних
- 7. Майкл Фарадей запропонував поділити речовини на дві групи за здатністю проводити струм.
- 8. Натисніть Натисніть Клас сполук Клас сполук Тип зв’язку Тип зв’язку
- 9. Чому електроліти проводять струм? При розчиненні речовини чи при сплавленні з’являються зарядженні частинки, які можуть вільно
- 10. Теорію електролітичної дисоціації сформулював швед Сванте Арреніус (1887 р.), за що у 1901 р. отримав Нобелівську
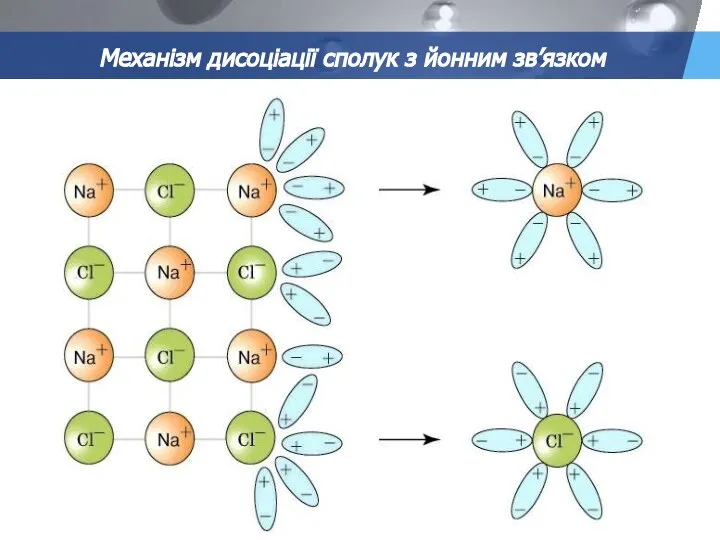
- 11. Механізм дисоціації сполук з йонним зв’язком
- 12. Прослідовність процесів: Орієнтація диполей води біля йонів кристалу. Гідратація - взаємодія молекул води з йонами Дисоціація
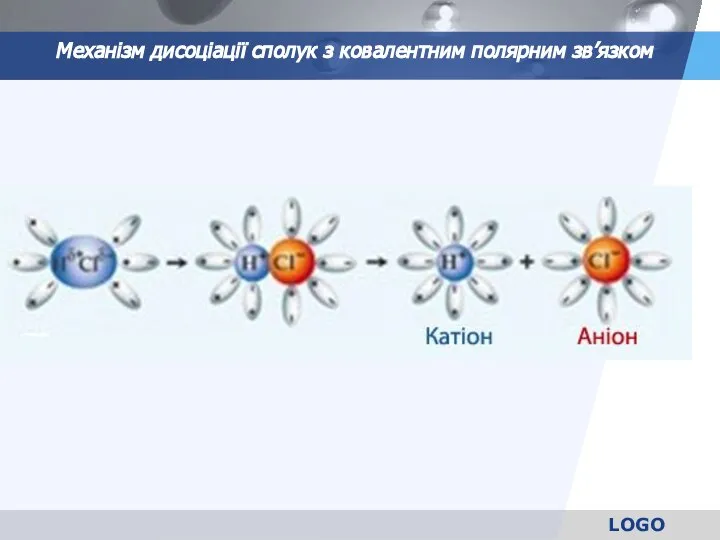
- 13. Механізм дисоціації сполук з ковалентним полярним зв’язком
- 14. Механізм дисоціації сполук з ковалентним полярним зв’язком Прослідовність процесів: Орієнтація диполей води навколо полюсів молекули НСl
- 15. Сучасний зміст ТЕД можна звести до чотирьох основних положень.? I- положення: Всі речовини по їх здатності
- 16. ІІ положення :В розчинах електроліти дисоціюють (Розпадаються) на позитивні і негативні іони. ІІІ положення: Причиною дисоціації
- 17. слабкі > 30 % сильні 2 − 30 % средньої сили Ступінь електролітичної Дисоціації залежить від:
- 18. HSO3− H+ + SO32− Кислоти - електроліти, які при дисоціації утворюють катіони гідрогену і аніони кислотного
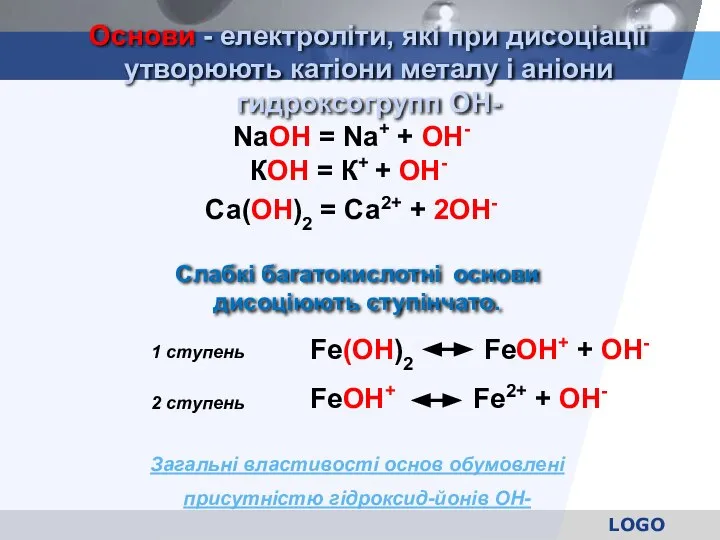
- 19. Основи - електроліти, які при дисоціації утворюють катіони металу і аніони гидроксогрупп ОН- NaOH = Na+
- 20. Середні солі - сильні електроліти, які при дисоціації утворюють катіони металу (або амонію NH4 +) і
- 21. Речовини , розчини яких проводять електричний струм. Процес розпаду електроліту на іони . Позитивно заряджені іони
- 22. На які групи можна поділити речовини за їх здатністю проводити електричний струм? Який вчений запропонував поділ
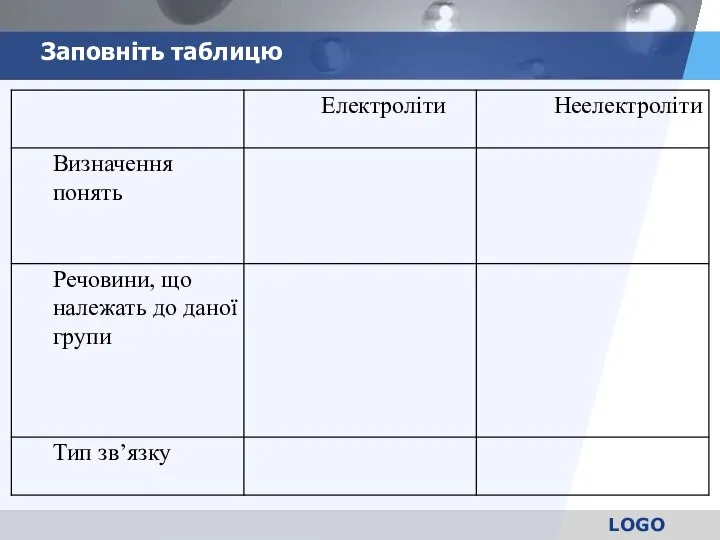
- 23. Заповніть таблицю
- 24. Підкресліть речовини – електроліти хлоридна кислота, кисень, натрій хлорид, натрій гідроксид, спирт, ацетон, кальцій гідроксид, глюкоза,
- 25. Які із зображених речовин будуть проводити електричний струм? Розчини солей Інертні гази та кисень Розчин натрій
- 27. Скачать презентацию


















 Общие свойства неметаллов
Общие свойства неметаллов Основные понятия и законы химии
Основные понятия и законы химии Неметаллы. Общая характеристика
Неметаллы. Общая характеристика Химические украшения из металла. Защита проекта
Химические украшения из металла. Защита проекта Chemia kosmetyczna
Chemia kosmetyczna 9-14 Реакции в растворах электролитов
9-14 Реакции в растворах электролитов Дифференциальный термический анализ
Дифференциальный термический анализ Mechanika płynów
Mechanika płynów Простые и сложные вещества
Простые и сложные вещества Тренинг по решению задач разной степени сложности по теме Углеводороды
Тренинг по решению задач разной степени сложности по теме Углеводороды Презентация на тему Неорганічні речовини живих організмів
Презентация на тему Неорганічні речовини живих організмів  Магний
Магний Основные положения о строении вещества
Основные положения о строении вещества Окислительновосстановительные реакции в z природе и жизни человека
Окислительновосстановительные реакции в z природе и жизни человека Общие способы получения металлов
Общие способы получения металлов Развитие химии
Развитие химии Понятие о предельных углеводородах. Алканы
Понятие о предельных углеводородах. Алканы Молекула воды, какая ты?
Молекула воды, какая ты? Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Презентация на тему Законы газового состояния вещества
Презентация на тему Законы газового состояния вещества  Строение атома. Экзаменационные вопросы
Строение атома. Экзаменационные вопросы Структура к свойства веществ
Структура к свойства веществ Исследование физико-химических свойств щавелевой кислоты
Исследование физико-химических свойств щавелевой кислоты Характеристика элемента по Периодической системе Д.И. Менделеева
Характеристика элемента по Периодической системе Д.И. Менделеева Соединения алюминия
Соединения алюминия Реактор гидроочистки дизельного топлива. Контроль и автоматизация
Реактор гидроочистки дизельного топлива. Контроль и автоматизация Предмет органической химии
Предмет органической химии 9_OSNOVY_KOLANALIZA
9_OSNOVY_KOLANALIZA