Содержание
- 2. Вещества, находящиеся в чистом состоянии, самопроизвольно стремятся перейти в раствор. Исследования свойств растворов, предпринятые на рубеже
- 5. Лабораторный прибор для обнаружения электропроводности растворов
- 6. Вещества, растворы или расплавы которых способны проводить электрический ток, называются электролитами. Соответственно, вещества, растворы или расплавы
- 7. Идеи С. Аррениуса, разработанные в 1887 г. составили основу теории электролитической диссоциации. Согласно ей, при растворении
- 8. Диссоциация характеризуется степенью электролитической диссоциации α - числом, показывающим, какая часть молекул электролита находится в растворе
- 10. Диссоциация слабых электролитов – обратимый процесс. Его можно представить как AB ↔ A+ + B- Применяя
- 12. Скачать презентацию
Слайд 2Вещества, находящиеся в чистом состоянии, самопроизвольно стремятся перейти в раствор. Исследования свойств
Вещества, находящиеся в чистом состоянии, самопроизвольно стремятся перейти в раствор. Исследования свойств

растворов, предпринятые на рубеже XIX – XX вв. привели к созданию так называемой физической теории растворов, построенной на аналогии между растворами и смесями газов. При этом предполагалось, что молекулы растворенного вещества и растворителя в известной мере индифферентны (безразличны) по отношению друг к другу.
Физическая теория растворов является противоположностью химической теории Д. И. Meнделеева. Однако, хотя физическая теория хорошо описывала поведение растворов неэлектролитов - веществ, растворы которых не проводят электрический ток, все попытки применения найденных закономерностей по отношению к растворам электролитов - веществ, растворы которых проводят электрический ток, были безуспешными.
В настоящее время выяснилось, что обе теории были в равной степени правы и сейчас процесс растворения рассматривается как физико-химический процесс, а растворы - как физико-химические системы.
Физическая теория растворов является противоположностью химической теории Д. И. Meнделеева. Однако, хотя физическая теория хорошо описывала поведение растворов неэлектролитов - веществ, растворы которых не проводят электрический ток, все попытки применения найденных закономерностей по отношению к растворам электролитов - веществ, растворы которых проводят электрический ток, были безуспешными.
В настоящее время выяснилось, что обе теории были в равной степени правы и сейчас процесс растворения рассматривается как физико-химический процесс, а растворы - как физико-химические системы.
Слайд 5Лабораторный прибор для обнаружения электропроводности растворов
Лабораторный прибор для обнаружения электропроводности растворов

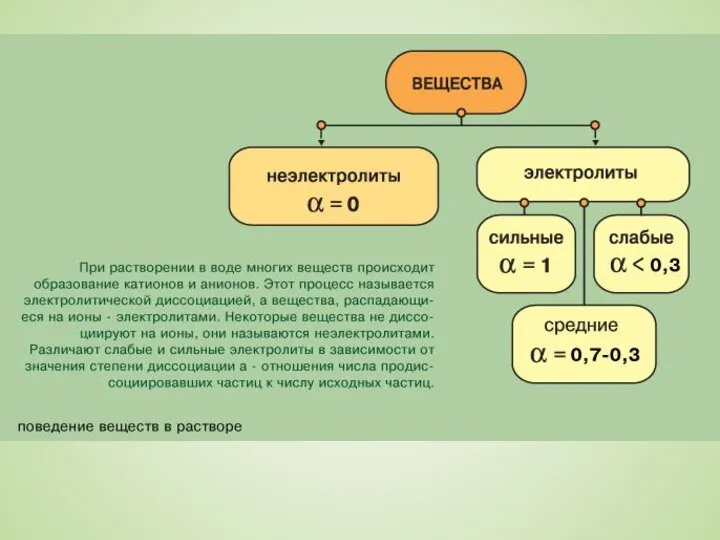
Слайд 6Вещества, растворы или расплавы которых способны проводить электрический ток, называются электролитами. Соответственно,
Вещества, растворы или расплавы которых способны проводить электрический ток, называются электролитами. Соответственно,

вещества, растворы или расплавы которых не проводят электрического тока, называются неэлектролитами.
Электролитами являются кислоты, основания и большинство солей, неэлектролитами - почти все органические соединения.
В растворе или расплаве электролиты распадаются на ионы - диссоциируют.
Распад электролитов на ионы при растворении их в воде называется электролитической диссоциацией.
Электролитическая диссоциация происходит вследствие взаимодействия полярных молекул растворителя с молекулами или кристаллической решеткой растворяемого вещества. Молекулы растворителя разрушают кристаллическую решетку и переводят ионы в раствор в форме сольватированных заряженных частиц. Растворенное вещество и растворитель оказывают обоюдное влияние: полярные молекулы растворителя разрушают кристаллическую решетку, а высвобождающиеся ионы, переходя в раствор, вызывают упорядочивание молекул растворителя. В то же время полярные молекулы растворителя ориентированы в соответствии с зарядом ионов.
Электролитами являются кислоты, основания и большинство солей, неэлектролитами - почти все органические соединения.
В растворе или расплаве электролиты распадаются на ионы - диссоциируют.
Распад электролитов на ионы при растворении их в воде называется электролитической диссоциацией.
Электролитическая диссоциация происходит вследствие взаимодействия полярных молекул растворителя с молекулами или кристаллической решеткой растворяемого вещества. Молекулы растворителя разрушают кристаллическую решетку и переводят ионы в раствор в форме сольватированных заряженных частиц. Растворенное вещество и растворитель оказывают обоюдное влияние: полярные молекулы растворителя разрушают кристаллическую решетку, а высвобождающиеся ионы, переходя в раствор, вызывают упорядочивание молекул растворителя. В то же время полярные молекулы растворителя ориентированы в соответствии с зарядом ионов.
Слайд 7Идеи С. Аррениуса, разработанные в 1887 г. составили основу теории электролитической диссоциации.
Идеи С. Аррениуса, разработанные в 1887 г. составили основу теории электролитической диссоциации.

Согласно ей, при растворении в воде электролиты диссоциируют (распадаются) на положительные и отрицательные частицы. Под действием постоянного электрического тока неупорядоченное движение ионов в растворе или расплаве прекращается: положительно заряженные ионы (они называются катионами) движутся к катоду, отрицательно заряженные (называются анионами) - к аноду. Соответственно, на катоде минус, а на аноде – плюс. Одновременно с распадом электролита на ионы происходит объединение ионов в молекулы. Поэтому электролитическая диссоциация является обратимым процессом и при написании уравнений диссоциации указывается, что реакция идет в обе стороны.
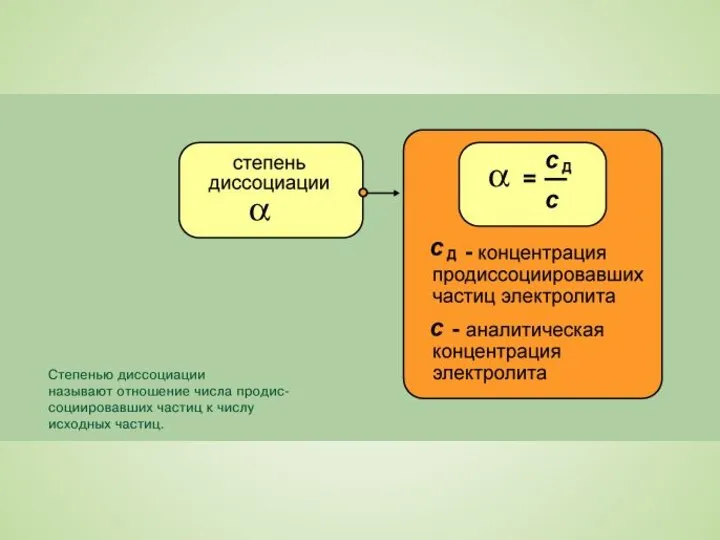
Слайд 8Диссоциация характеризуется степенью электролитической диссоциации α - числом, показывающим, какая часть молекул
Диссоциация характеризуется степенью электролитической диссоциации α - числом, показывающим, какая часть молекул

электролита находится в растворе в виде ионов, т.е. как отношение продиссоциировавших молекул к общему числу молекул в растворе. Обычно ее выражают в долях единицы или в процентах. В растворах неэлектролитов, где распад на ионы полностью отсутствует, α = 0, а в растворах, в которых все растворенное вещество присутствует в форме ионов, α = 1. Такое деление является в значительной степени условным, что объясняется зависимостью степени диссоциации от природы электролита и растворителя, концентрации и температуры раствора.
К сильным электролитам относят вещества, которые практически полностью диссоциируют на ионы, α ≈ 1. Это сильные кислоты, гидроксиды и почти все соли. Слабыми электролитами считаются вещества, диссоциирующие на ионы в незначительной степени ( α < 0.3). В основном это слабые кислоты и многие основания, у которых большая часть растворенного вещества находится в молекулярной форме. Существует также небольшая группа электролитов средней силы, у которых степень диссоциации α больше 0.3 и меньше 0.7.
К сильным электролитам относят вещества, которые практически полностью диссоциируют на ионы, α ≈ 1. Это сильные кислоты, гидроксиды и почти все соли. Слабыми электролитами считаются вещества, диссоциирующие на ионы в незначительной степени ( α < 0.3). В основном это слабые кислоты и многие основания, у которых большая часть растворенного вещества находится в молекулярной форме. Существует также небольшая группа электролитов средней силы, у которых степень диссоциации α больше 0.3 и меньше 0.7.
Слайд 10Диссоциация слабых электролитов – обратимый процесс. Его можно представить как
AB ↔ A+
Диссоциация слабых электролитов – обратимый процесс. Его можно представить как
AB ↔ A+
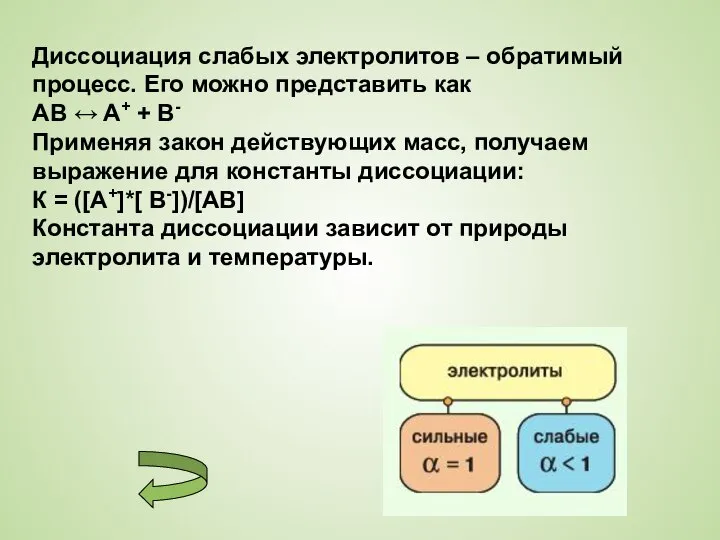
+ B-
Применяя закон действующих масс, получаем выражение для константы диссоциации:
К = ([A+]*[ B-])/[AB]
Константа диссоциации зависит от природы электролита и температуры.
Применяя закон действующих масс, получаем выражение для константы диссоциации:
К = ([A+]*[ B-])/[AB]
Константа диссоциации зависит от природы электролита и температуры.
- Предыдущая
Fauna of AustraliaСледующая -
Пересказ загадочных историй по Н. Сладкову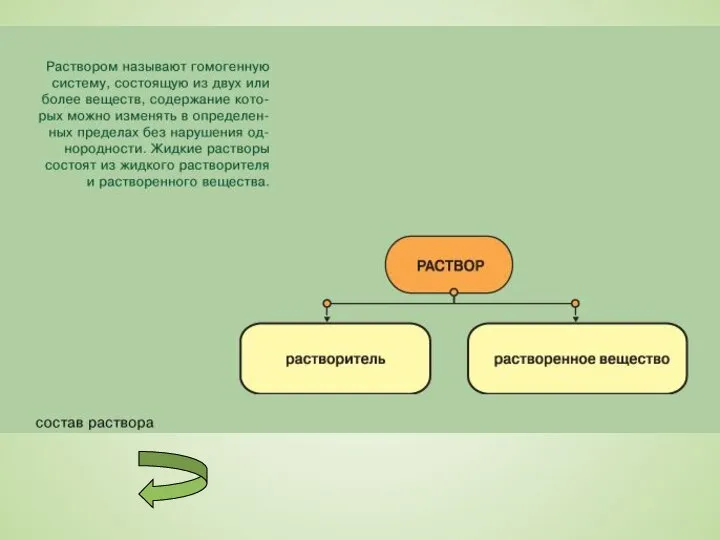
 Презентация на тему Химические Недотроги
Презентация на тему Химические Недотроги  Непредельные карбоновые кислоты
Непредельные карбоновые кислоты Алюминий
Алюминий Химическая связь. Типы кристаллических решёток
Химическая связь. Типы кристаллических решёток Окислительно – восстановительные реакции (урок химии в 11 классе)
Окислительно – восстановительные реакции (урок химии в 11 классе) Простые вещества - неметаллы
Простые вещества - неметаллы Оксиды и гидроксиды металлов
Оксиды и гидроксиды металлов Переваривание и всасывание жиров
Переваривание и всасывание жиров Химическое равновесие
Химическое равновесие Химия в быту
Химия в быту Презентация на тему Оксид кремния
Презентация на тему Оксид кремния  Метод окислительно - восстановительного титрования
Метод окислительно - восстановительного титрования Классы неорганических веществ
Классы неорганических веществ Карбоновые кислоты и их производные
Карбоновые кислоты и их производные Химическая связь
Химическая связь Изомерия
Изомерия Полисахариды. Крахмал и целлюлоза
Полисахариды. Крахмал и целлюлоза Кислород как вещество
Кислород как вещество Углерод. Положение в ПС и особенности строения атома
Углерод. Положение в ПС и особенности строения атома Химический состав клетки. Урок биологии в 10 классе
Химический состав клетки. Урок биологии в 10 классе Трёхкомпонентные системы. Лекция 25
Трёхкомпонентные системы. Лекция 25 Арены. Бензол
Арены. Бензол Алициклические и гетероциклические соединения. Тема № 7, 8
Алициклические и гетероциклические соединения. Тема № 7, 8 Кинетика химических и биохимических процессов. Часть 1
Кинетика химических и биохимических процессов. Часть 1 Скорость химических реакций
Скорость химических реакций Получение и свойства полиэтилена
Получение и свойства полиэтилена 564481
564481 Арбузный снег. Предположения
Арбузный снег. Предположения