Содержание
- 2. Расчёты по химическим уравнениям. N – число частиц (атомов или молекул) ν – количество вещества (моль)
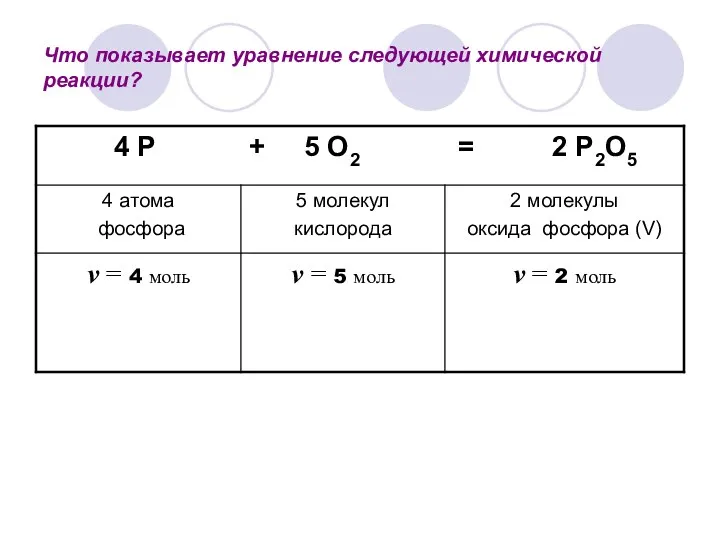
- 3. Что показывает уравнение следующей химической реакции?
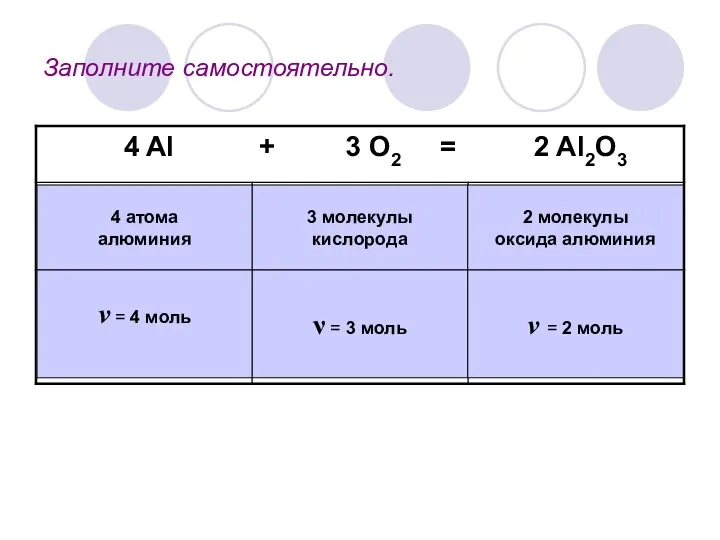
- 4. Заполните самостоятельно. 4 атома алюминия 3 молекулы кислорода 2 молекулы оксида алюминия ν = 4 моль
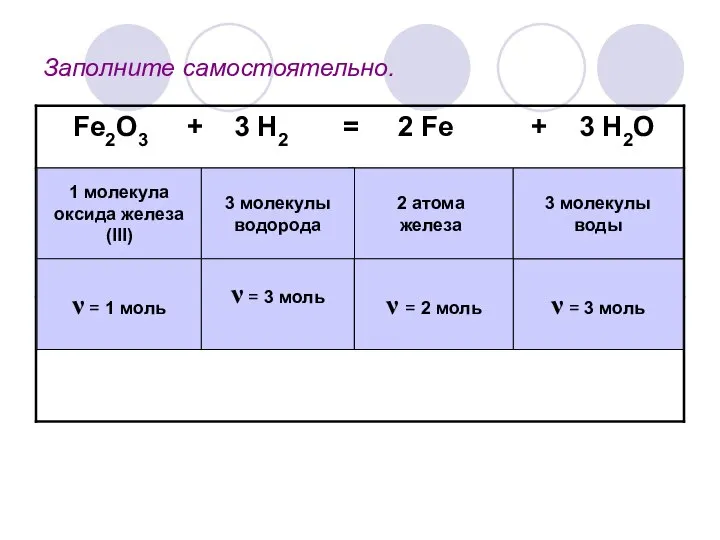
- 5. Заполните самостоятельно. 2 атома железа 3 молекулы водорода 1 молекула оксида железа(III) ν = 3 моль
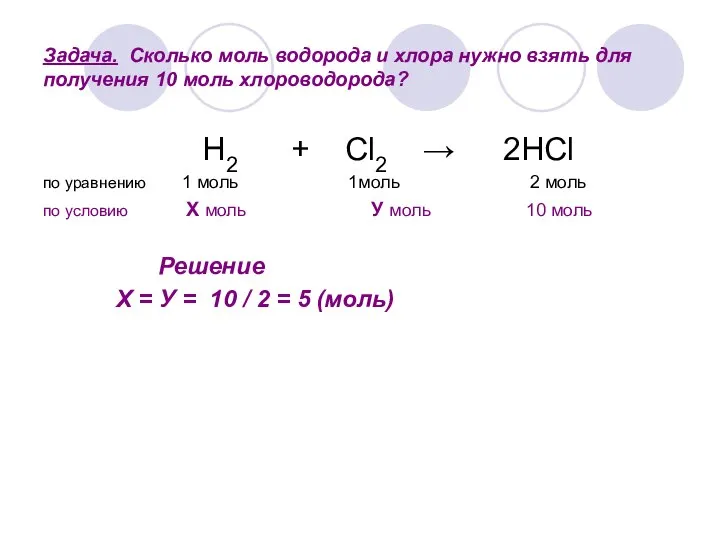
- 6. Задача. Сколько моль водорода и хлора нужно взять для получения 10 моль хлороводорода? H2 + Cl2
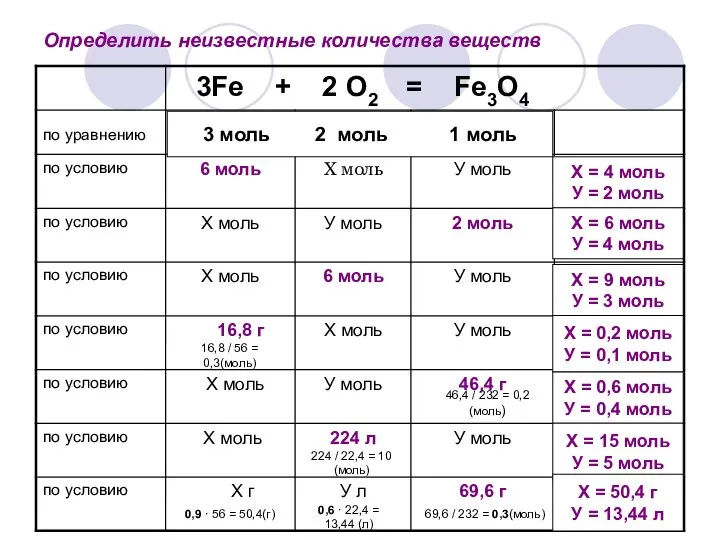
- 7. Определить неизвестные количества веществ 3 моль 2 моль 1 моль Х = 4 моль У =
- 8. Упрощённая блок-схема для решения задач m(смеси) ←ω→ m (вещ-ва) ←М→ ν(вещ.) ←Vm→ V(вещ) ←ω→ V(смеси) уравнение
- 9. Задача. Сколько литров углекислого газа (СО2) образуется при сжигании 48 граммов угля (С)? 1) ν(С) =
- 10. Упрощённая блок-схема для решения задач m(смеси) ←ω→ m (вещ-ва) ←М→ ν(вещ.) ←Vm→ V(вещ) ←ω→ V(смеси) уравнение
- 11. Задача. Какой объём водорода выделится при взаимодействии магния с 20 граммами раствора серной кислоты, массовая доля
- 12. Задача. Сколько граммов гидроксида меди(II) может прореагировать с 73 граммами 10%-ной соляной кислоты? mр(HCl)= 73 г
- 13. Задача. Вычислите массу железа, необходимого для получения 39 г хлорида железа(III). Схема уравнения реакции следующая: Fe
- 14. Задача. Вычислите массу оксида, полученного при окислении 60 г мышьяка. Схема уравнения реакции следующая: As +
- 15. Задача. Какой объём водорода образуется при взаимодействии 30 граммов кальция, содержащего 20% примеси, с водой? m
- 16. Задача. Какой объём углекислого газа(CO2) образуется при разложении 250 граммов известняка (СаСО3), содержащего 20% примеси? m
- 18. Скачать презентацию










 Титриметрический анализ. Основные понятия
Титриметрический анализ. Основные понятия Сера. Немного истории
Сера. Немного истории Спирты. Классификация, номенклатура, изомерия, получение и применение. 10 класс
Спирты. Классификация, номенклатура, изомерия, получение и применение. 10 класс 4 Минеральные удобрения (1)
4 Минеральные удобрения (1) Турнир знатоков химии
Турнир знатоков химии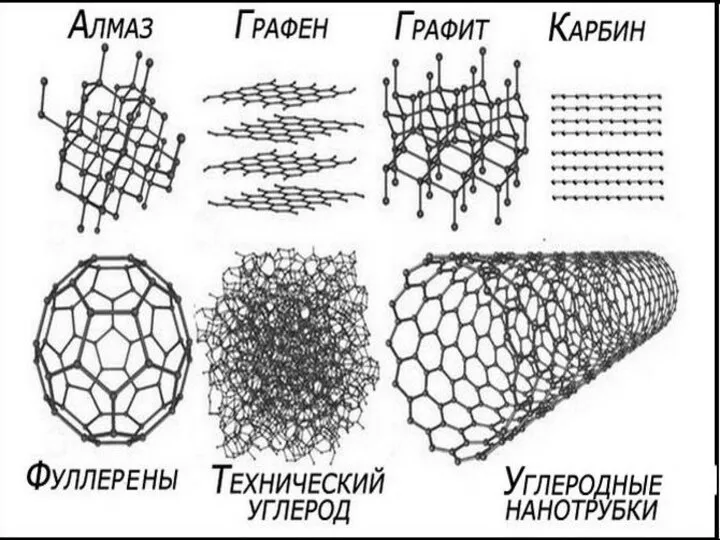 Углеродные нанотрубки
Углеродные нанотрубки Cера как представитель халькогенов
Cера как представитель халькогенов Кислород – это самый распространенный на нашей планете элемент
Кислород – это самый распространенный на нашей планете элемент Практические занятия по теме: Методы защиты энергооборудования от коррозии (1)
Практические занятия по теме: Методы защиты энергооборудования от коррозии (1) Коррозия металлов
Коррозия металлов Влияние инициаторов на реакцию полимеризации стирола
Влияние инициаторов на реакцию полимеризации стирола Гидроксид кальция – гашеная известь
Гидроксид кальция – гашеная известь Химические элементы. Викторина
Химические элементы. Викторина Тяжелосредные гидроциклоны
Тяжелосредные гидроциклоны Мономеры
Мономеры Характеристика кислорода и серы
Характеристика кислорода и серы Минералы и горные породы
Минералы и горные породы Презентация на тему Вопросы от …
Презентация на тему Вопросы от …  Знаки химических элементов. Периодическая система
Знаки химических элементов. Периодическая система Умники и умницы в Королевстве Химических наук
Умники и умницы в Королевстве Химических наук Водород. Свойства, применение
Водород. Свойства, применение Кинетика физико-химических процессов
Кинетика физико-химических процессов Химические уравнения
Химические уравнения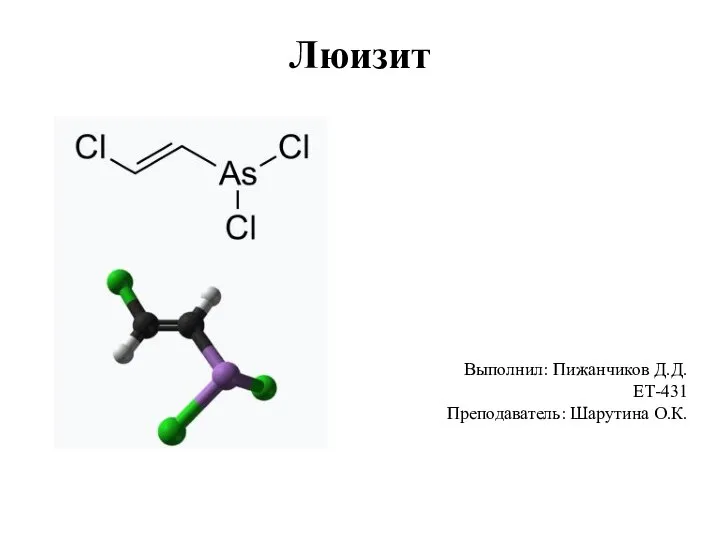 Люизит. Физические и химические свойства вещества. Действие на организм человека
Люизит. Физические и химические свойства вещества. Действие на организм человека Галогеноалканы: получение, свойства и применение
Галогеноалканы: получение, свойства и применение Растворение +СО2 + в +Н2О. Агрегатное состояние вещества
Растворение +СО2 + в +Н2О. Агрегатное состояние вещества Дефекты в кристаллах
Дефекты в кристаллах Азот
Азот