Содержание
- 2. Немало сера знаменита, И в древности её Гомер воспел, С ней много тысяч лет прожито, И
- 3. S 16+ 2 18 6 O S ЭО = 3,44 ЭО = 2,58 Степени окисления +4
- 4. Аллотропные модификации серы ромбическая моноклинная пластическая Хрупкое, жёлтое вещество. Легко измельчается в порошок. S8 Tпл. 112,8
- 5. Сера не растворяется в воде. Кристаллы серы в воде тонут, а порошок плавает по поверхности. Сера
- 6. Сера и роман А. Дюма «Граф Монте-Кристо».
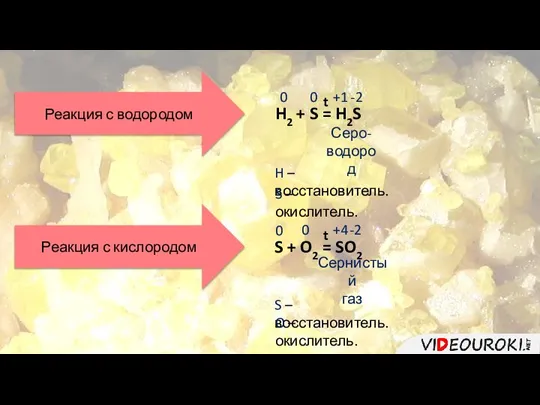
- 7. Реакции с металлами Ca + S = CaS Сульфид кальция 0 +2 -2 0 Ca –
- 8. Реакция с водородом H2 + S = H2S t Серо- водород 0 0 +1 -2 H
- 10. Соединения серы ZnS HgS PbS FeS2 CuS Na2SO4 · 10H2O CaSO4 · 2H2O MgSO4 · 7H2O
- 11. Сера входит в состав белков. Сера входит в состав гормонов и витаминов. Сера участвует в окислительно-восстановительных
- 12. Продукты, содержащие серу
- 13. Применение серы
- 14. H2S Сероводород Сероводород представляет собой бесцветный газ с резким запахом. Он ядовит и вызывает отравление даже
- 15. H2S Сероводород Сероводород входит в состав некоторых минеральных вод. Сероводород содержится в вулканических газах и постоянно
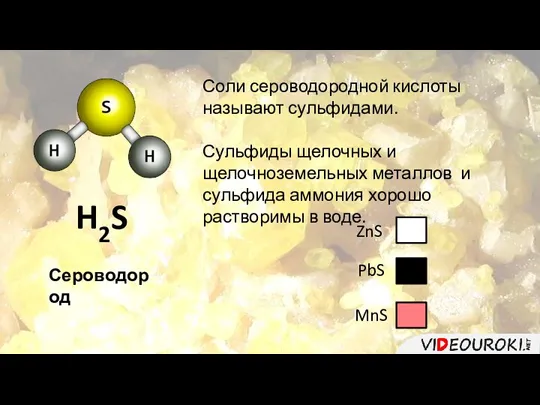
- 16. H2S Сероводород Соли сероводородной кислоты называют сульфидами. Сульфиды щелочных и щелочноземельных металлов и сульфида аммония хорошо
- 17. Получение сероводорода В лаборатории FeS + 2HCl = FeCl2 + H2S↑ Горение сероводорода 2H2S + 3O2
- 18. H2S ↔ H+ + HS- HS- ↔ H+ + S2- Диссоциация сероводородной кислоты: Раствор сероводорода в
- 19. Оксид серы (IV) S + O2 = SO2 Это бесцветный газ с резким запахом. Тяжелее воздуха.
- 20. Оксид серы (IV) – кислотный оксид. При растворении в воде образует сернистую кислоту. H2O + SO2
- 21. Сера – элемент VIA группы. У серы 6 электронов на внешнем энергетическом уровне. В соединениях сера
- 23. Скачать презентацию


















 Химическая организация клетки
Химическая организация клетки Резиновые материалы и клеи. Тема 7.5
Резиновые материалы и клеи. Тема 7.5 Презентация по Химии "Стиральные порошки и их экологическое воздействие на окружающую среду"
Презентация по Химии "Стиральные порошки и их экологическое воздействие на окружающую среду"  Анодное растворение mn5si3-электрода в сернокислом фторидсодержащем электролите
Анодное растворение mn5si3-электрода в сернокислом фторидсодержащем электролите Винная кислота
Винная кислота Химические свойства основных классов неорганических соединений
Химические свойства основных классов неорганических соединений Строение электронных оболочек атома
Строение электронных оболочек атома Минералы и горные породы
Минералы и горные породы Презентация на тему Основные законы химии
Презентация на тему Основные законы химии  Определение содержания витамина С в домашних условиях
Определение содержания витамина С в домашних условиях Галогены. 9 класс
Галогены. 9 класс 9_OSNOVY_KOLANALIZA
9_OSNOVY_KOLANALIZA Уравнения химических реакций
Уравнения химических реакций Алкены
Алкены Влияние бытовой химии на здоровье человека
Влияние бытовой химии на здоровье человека Пайданалылған майларды қолдана отырып көмірді брикеттер алу
Пайданалылған майларды қолдана отырып көмірді брикеттер алу Валентность
Валентность Угольная кислота и ее соли
Угольная кислота и ее соли Полиэтилен-1
Полиэтилен-1 Основные понятия органической химии
Основные понятия органической химии Лиофобные дисперсные системы. Конденсация. Растворение. Флокуляция. Лекция 13
Лиофобные дисперсные системы. Конденсация. Растворение. Флокуляция. Лекция 13 Решение задач на примере работы реакторов для реализации гетерогенных некаталитических процессов. Практическая работа
Решение задач на примере работы реакторов для реализации гетерогенных некаталитических процессов. Практическая работа Основания
Основания Органическая химия
Органическая химия Неметаллы. 11 класс
Неметаллы. 11 класс Презентация на тему Жидкое состояние вещества
Презентация на тему Жидкое состояние вещества  Сложные эфиры. Жиры. Мыла
Сложные эфиры. Жиры. Мыла Сложные эфиры
Сложные эфиры