Содержание
- 2. Сванте Август Аррениус (1859 – 1927) - основатель теории электролитической диссоциации
- 3. 2.Электролитическая диссоциация процесс распада молекул электролита на ионы в растворе или расплаве. Электролитическая диссоциация -
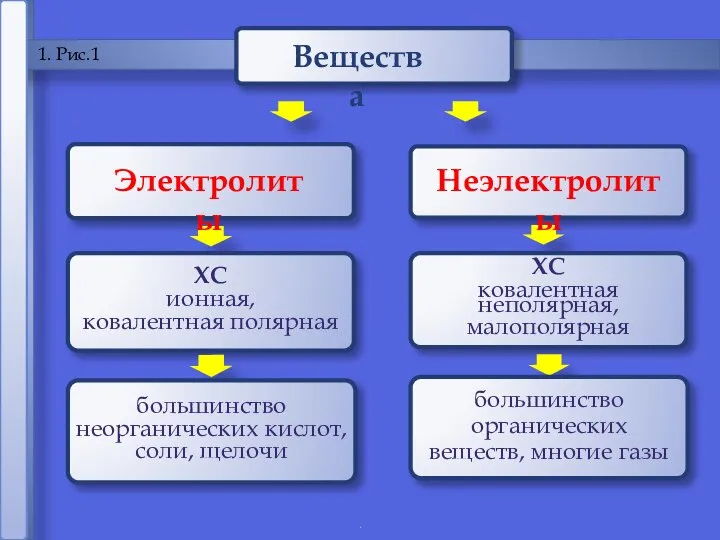
- 4. . 1 1. Рис.1 Электролиты Неэлектролиты
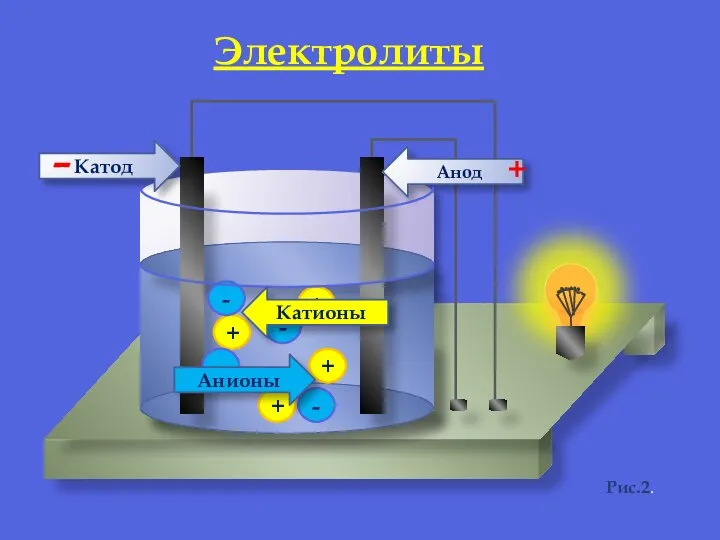
- 5. 1. Электролиты и неэлектролиты это вещества, растворы и расплавы которых проводят электрический ток. Электролиты -
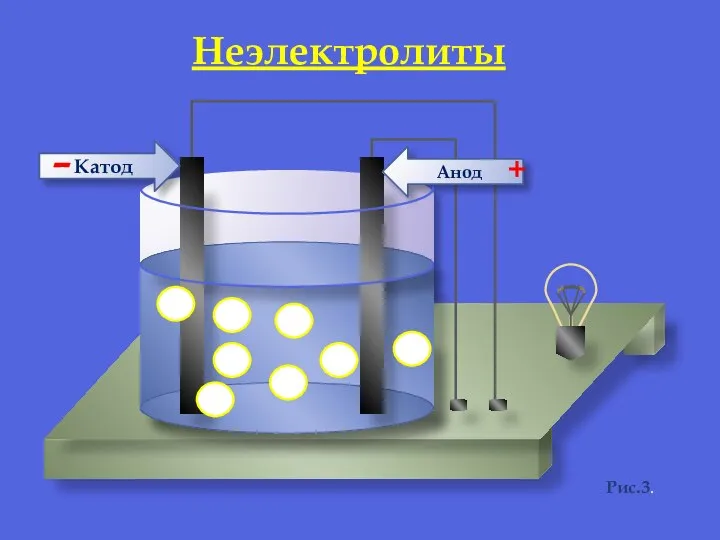
- 6. 1. Электролиты и неэлектролиты это вещества, растворы или расплавы которых не проводят электрический ток. Неэлектролиты -
- 7. + + + + - - - - Анионы Катионы Анод Катод - + Электролиты Рис.2.
- 8. Анод Катод - + Рис.3. Неэлектролиты
- 9. 1. Электролиты и неэлектролиты Вода – хороший растворитель, т.к. молекулы воды полярны. слабый амфотерный электролит. ион
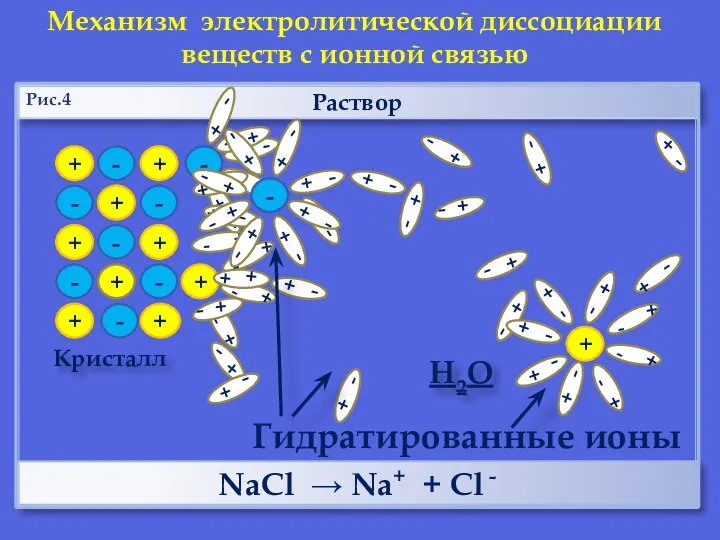
- 10. + + - - + + - - Раствор Кристалл - + + + - -
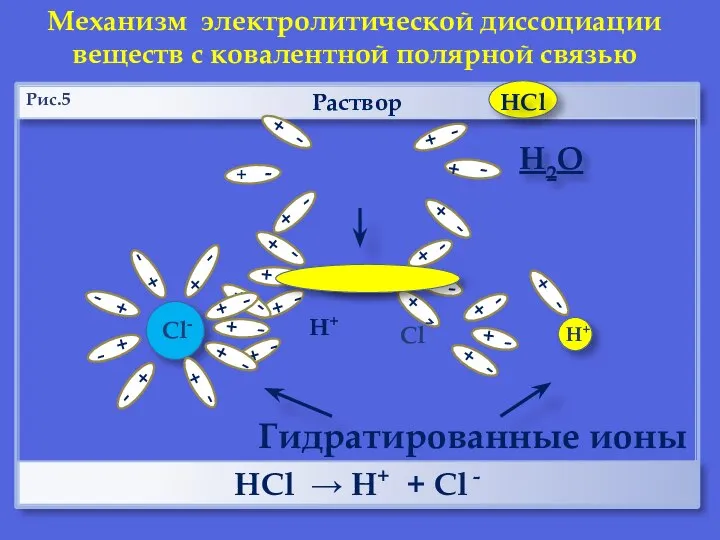
- 11. Раствор НCl → Н+ + Cl - Механизм электролитической диссоциации веществ с ковалентной полярной связью Н2О
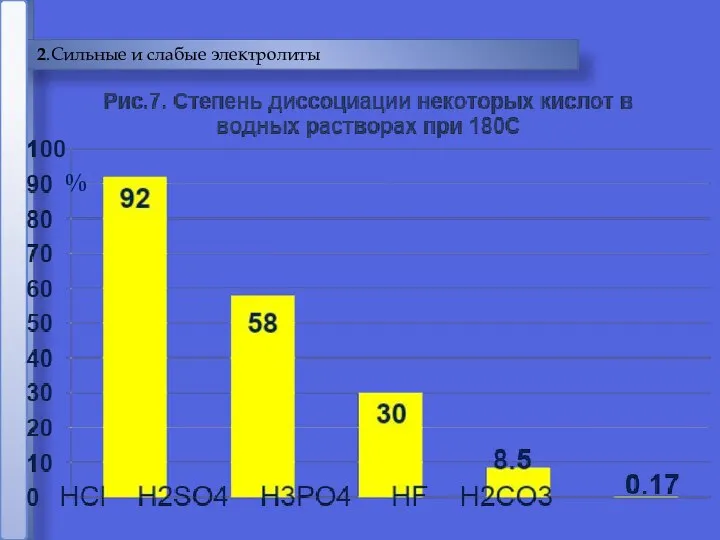
- 12. 2.Сильные и слабые электролиты HCl + + + Сильные и слабые Рис.6.
- 13. отношение числа диссоциированных молекул к общему числу молекул, находящихся в растворе. Степень электролитической диссоциации (α) -
- 14. 2.Сильные и слабые электролиты %
- 15. 1. Все металлы проводят электрический ток, следовательно, все металлы -электролиты.
- 16. 2. Если встать в лужу, в которой лежит оголенный провод, находящийся под напряжением, можно получить смертельный
- 17. 3. В дистиллированной воде приготовили настой лечебных плодов (шиповника, черники, калины). Настой стал проводить электрический ток.
- 18. 4. При рентгеноскопии желудка пациенту дают выпить взвесь BaSO4. Объясните, почему чистый BaSO4 не вызывает отравлений,
- 19. это сложные вещества, при диссоциации которых в водных растворах в качестве катионов отщепляются только ионы водорода.
- 20. это сложные вещества, при диссоциации которых в водных растворах в качестве анионов отщепляются только гидроксид-ионы. Основания
- 21. это сложные вещества, которые в водных растворах диссоциируют на катионы металла и анионы кислотного остатка. Соли
- 22. Электролитическая диссоциация Лабораторный опыт 1. В две пробирки насыпать обезвоженный сульфат меди. В одну из пробирок
- 23. Электролитическая диссоциация Лабораторный опыт 2. В две сухие пробирки насыпать немного кристаллического гидроксида кальция (или оксида
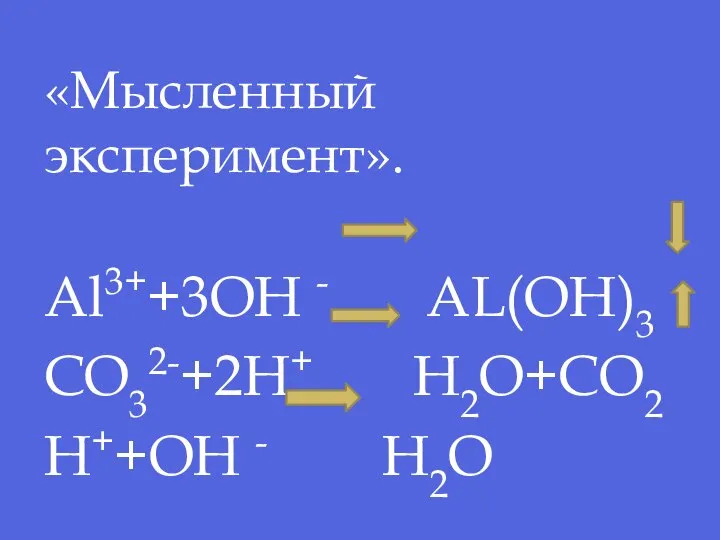
- 24. «Мысленный эксперимент». Al3++3OH - AL(OH)3 CO32-+2H+ H2O+CO2 H++OH - H2O
- 25. 6. Рис.8. Характерные симптомы дефицита химических элементов в организме человека
- 26. 6. О значении электролитов для живых организмов Электролитическая диссоциация Электролиты – составная часть жидкостей и плотных
- 28. Скачать презентацию


















 Закономерности протеканий химических реакций
Закономерности протеканий химических реакций Презентация лек №2
Презентация лек №2 Карбид кремния
Карбид кремния Тест по неметаллам
Тест по неметаллам История развития органической химии
История развития органической химии Галогены. 9 класс
Галогены. 9 класс Совершенствование железооксидного катализатора дегидрирования за счет стабилизации ферритных фаз
Совершенствование железооксидного катализатора дегидрирования за счет стабилизации ферритных фаз Кислород. Оксиды. Валентность
Кислород. Оксиды. Валентность Задачи на ионные равновесия
Задачи на ионные равновесия Своя игра. Атомы
Своя игра. Атомы Вязкоупругие свойства полимеров
Вязкоупругие свойства полимеров Теоретические основы органической химии. Лекция 25
Теоретические основы органической химии. Лекция 25 Криогенный разрыв пласта
Криогенный разрыв пласта Ионная химическая связь
Ионная химическая связь Получение формальдегида методом дегидрирования метанола
Получение формальдегида методом дегидрирования метанола Электролитическая диссоциация
Электролитическая диссоциация Медь и её сплавы
Медь и её сплавы Путешествие в мир кислот
Путешествие в мир кислот Презентация на тему Химические вещества: строительные и поделочные материалы
Презентация на тему Химические вещества: строительные и поделочные материалы  Premeny látok. Požiar a jeho hasenie
Premeny látok. Požiar a jeho hasenie Жиры. Определение и общая формула
Жиры. Определение и общая формула Химический канцерогенез
Химический канцерогенез Двовимірний ямр. Основні принципи
Двовимірний ямр. Основні принципи Качественные реакции в химии
Качественные реакции в химии Классы неорганических веществ. Игра для 9 класса
Классы неорганических веществ. Игра для 9 класса Лекция 3. Строение электронной оболочки атома (1)
Лекция 3. Строение электронной оболочки атома (1) Лавка возможностей
Лавка возможностей Свойства ртути
Свойства ртути