Слайд 2
Нітратна кислота HNO3 характеризується деякими специфічними властивостями. Вона є сильним
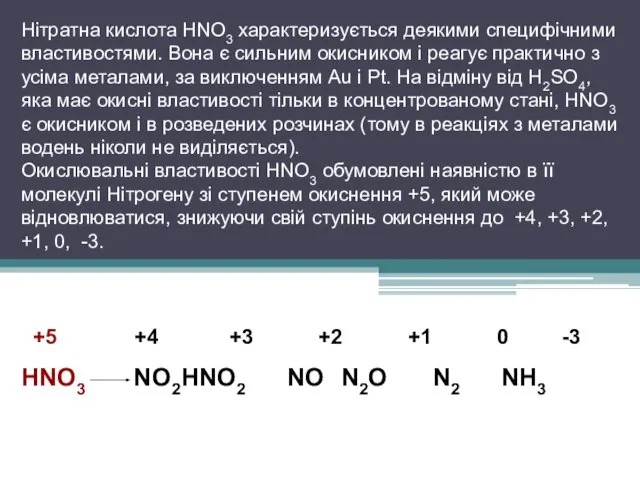
окисником і реагує практично з усіма металами, за виключенням Au і Pt. На відміну від H2SO4, яка має окисні властивості тільки в концентрованому стані, HNO3 є окисником і в розведених розчинах (тому в реакціях з металами водень ніколи не виділяється).
Окислювальні властивості HNO3 обумовлені наявністю в її молекулі Нітрогену зі ступенем окиснення +5, який може відновлюватися, знижуючи свій ступінь окиснення до +4, +3, +2, +1, 0, -3.
+5 +4 +3 +2 +1 0 -3
HNO3 NO2 HNO2 NO N2O N2 NH3
Слайд 3
Ме + HNO3 Ме(NO3)n+ + Н2О
Взаємодія HNO3 з металами.
водень не
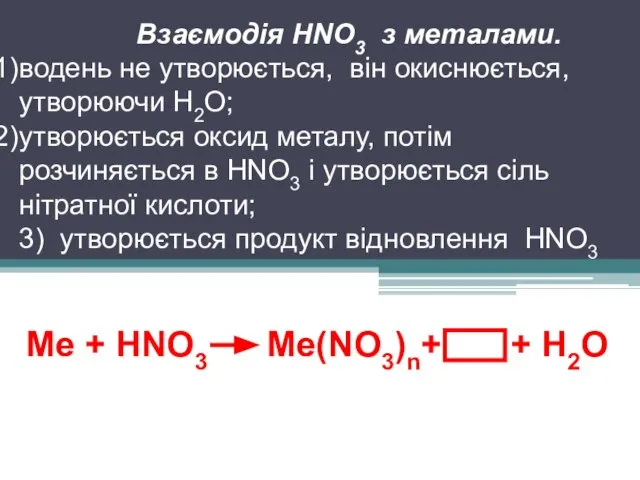
утворюється, він окиснюється, утворюючи Н2О;
утворюється оксид металу, потім розчиняється в HNO3 і утворюється сіль нітратної кислоти;
3) утворюється продукт відновлення HNO3
Слайд 4HNO3
Концентрована
Розведена
З лужно-
земельними,
а також
Zn
З
важкими
металами
+Fe
З лужними
і лужно-
земельними
металами.
З важкими
металами
Pb,Hg,
Ag,Cu.
На Au,
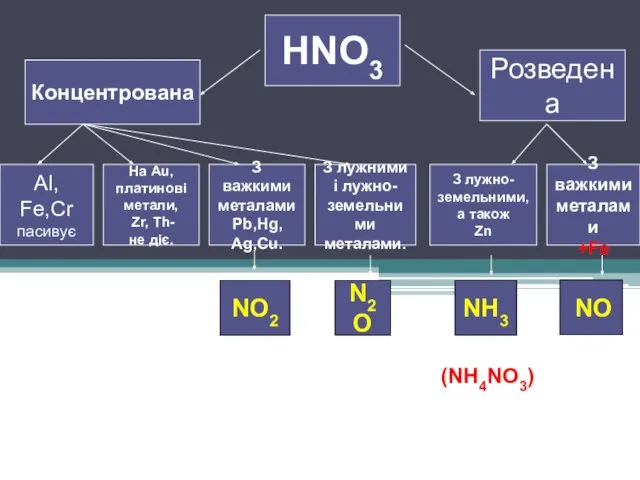
платинові
метали,
Zr, Th-
не діє.
Al, Fe,Cr
пасивує
NO2
N2O
NH3
NO
(NH4NO3)
Слайд 5Взаємодія HNO3 з міддю
Cu + 4HNO3 → Cu(NO3)2 + 2NO2↑+ H2O

бурий газ




 Контроль знаний на уроках химии
Контроль знаний на уроках химии Истина - дочь времени, а не авторитета
Истина - дочь времени, а не авторитета Невидиме чорнило
Невидиме чорнило Кинетическая устойчивость комплексов
Кинетическая устойчивость комплексов Понятие о предельных углеводородах. Алканы
Понятие о предельных углеводородах. Алканы Обобщение свойств углеводородов
Обобщение свойств углеводородов Спирты
Спирты Химические реакции. Классификация
Химические реакции. Классификация Основные физические и химические величины. Элективный курс в 10 классе Решение задач по химии
Основные физические и химические величины. Элективный курс в 10 классе Решение задач по химии Молекула воды, какая ты?
Молекула воды, какая ты? Минерал гранат
Минерал гранат romanchuk
romanchuk Железо в продуктах питания
Железо в продуктах питания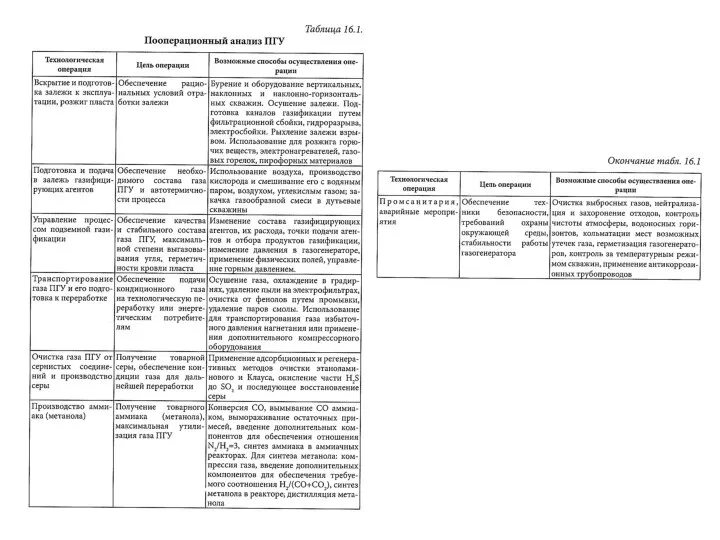 Пооперационный анализ ПГУ
Пооперационный анализ ПГУ Алгоритм решения задач по химии.
Алгоритм решения задач по химии. Условия хранения и подготовка скоропортящихся грузов к перевозкам
Условия хранения и подготовка скоропортящихся грузов к перевозкам Сера
Сера Химические реакции
Химические реакции Азотсодержащие. Амины (семинар)
Азотсодержащие. Амины (семинар) Інструктаж з БЖД. Особливості органічних сполук (порівняно з неорганічними). Вуглеводні. Метан
Інструктаж з БЖД. Особливості органічних сполук (порівняно з неорганічними). Вуглеводні. Метан Количество вещества
Количество вещества Железо и его сплавы
Железо и его сплавы Презентация
Презентация Образование растворов ВМС
Образование растворов ВМС Классификация неорганических соединений
Классификация неорганических соединений Алканы (строение и изомерия)
Алканы (строение и изомерия) Соли и их свойства
Соли и их свойства Оксиды в мире минералов
Оксиды в мире минералов