Содержание
- 2. Химические элементы – металлы. Из 114 известных элементов – 92 относятся к металлам. Металлы – это
- 3. Главные особенности элементов металлов. Малое число валентных электронов ( [1-3] ). Сравнительно большие радиусы атомов. Небольшие
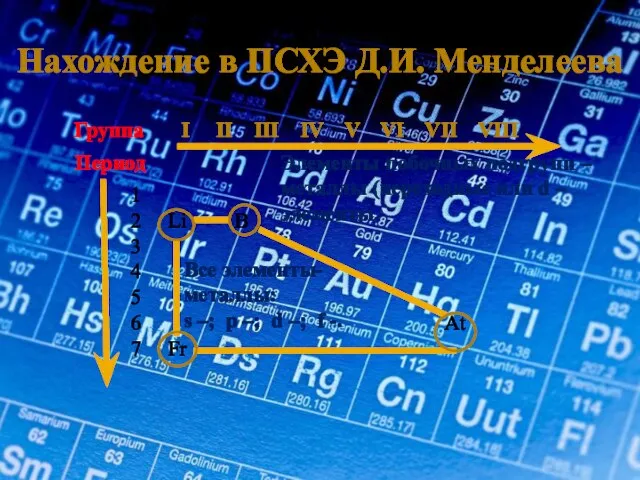
- 4. Нахождение в ПСХЭ Д.И. Менделеева Группа I II III IV V VI VII VIII Период 1
- 5. Изменение свойств в ПСХЭ Д.И. Менделеева Число электронов на внешнем слое не изменяется Радиус атома увеличивается
- 6. Изменение свойств в ПСХЭ Д.И. Менделеева В периоде: Заряды ядер увеличиваются Радиусы атомов уменьшаются Число электронов
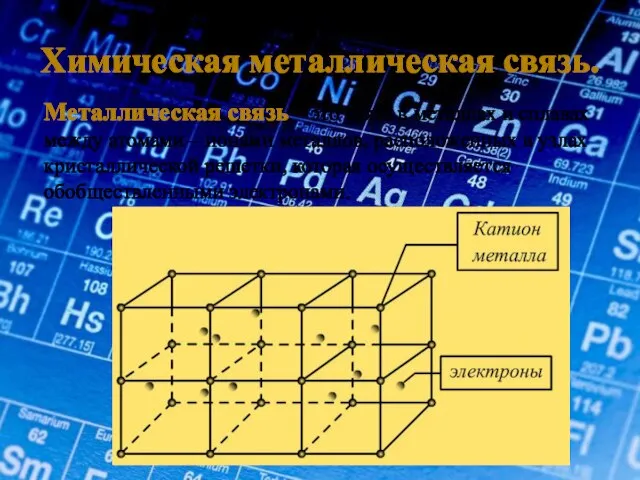
- 7. Химическая металлическая связь. Металлическая связь – это связь в металлах и сплавах между атомами – ионами
- 8. Особенности металлической связи. 1. Небольшое количество электронов одновременно связывают множество атомных ядер. 2. Связь нелокализована. 3.
- 9. Металлы – простые вещества. Все металлы обладают общими физическими свойствами: Пластичность – смещение слоев ионов под
- 10. Металлы – простые вещества. В атомах металлов на внешнем энергетическом уровне: Малое количество электронов. Очень большой
- 11. Электрохимический ряд напряжения металлов. Ме расположены в порядке убывания восстановительных свойств при реакциях в растворах; Ме,
- 12. Электрохимический ряд напряжения металлов. Ме, стоящие в ряду до Al, взаимодействуют с водой с образованием щелочей
- 13. Электрохимический ряд напряжения металлов. На основании восстановительной способности Ме в ряду напряжений УСЛОВНО можно разделить на
- 14. Взаимодействие Ме с простыми веществами. Ме Взаимодействие с кислородом/ оксиды, пероксиды Взаимодействие с серой/ сульфиды Взаимодействие
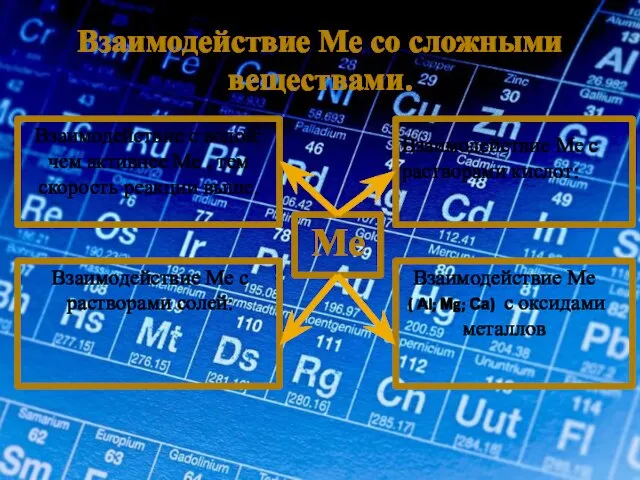
- 15. Взаимодействие Ме со сложными веществами. Ме Взаимодействие с водой: чем активнее Ме , тем скорость реакции
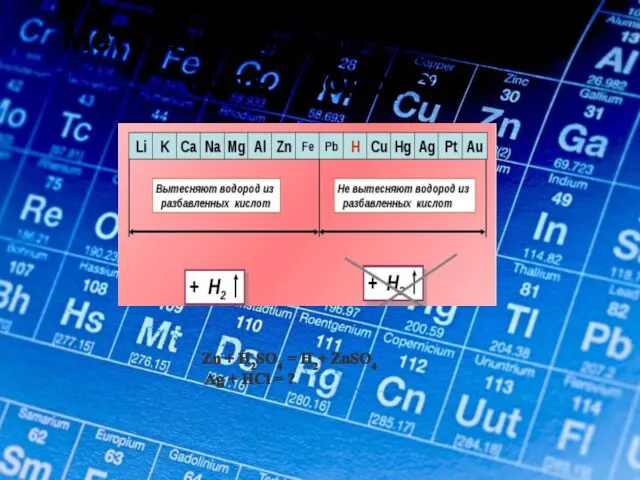
- 16. Металлы до водорода + кислота → соль + водород Zn + Н2SO4 = Н2+ ZnSO4 Ag
- 17. кальций + вода → ? серебро + вода → ? 3. цинк + вода → ?
- 18. Zn + CuSO4 = ? Ag + CuCl2 = ?
- 19. C оксидами металлов реагируют металлы ( Аl; Мg; Са) = оксид + металл1
- 21. Скачать презентацию

![Главные особенности элементов металлов. Малое число валентных электронов ( [1-3] ). Сравнительно](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/850101/slide-2.jpg)












 Типы кристаллических решёток
Типы кристаллических решёток Таблица Менделеева
Таблица Менделеева Химическая идентификация основных классов биомолекул
Химическая идентификация основных классов биомолекул Соль - без вины виновата
Соль - без вины виновата Вязкоупругие свойства полимеров
Вязкоупругие свойства полимеров Ориентация полимеров
Ориентация полимеров Массовая доля вещества в растворе
Массовая доля вещества в растворе Очистка хозяйственных и сточных вод от азота аммонийного с помощью нитрифицирующих бактерий
Очистка хозяйственных и сточных вод от азота аммонийного с помощью нитрифицирующих бактерий Выберите вещества
Выберите вещества Основы квантовой химии
Основы квантовой химии Теория электролитической диссоциации
Теория электролитической диссоциации Ковалентная полярная химическая связь
Ковалентная полярная химическая связь Химическая картина мира
Химическая картина мира Презентация на тему Величие гениального творчества великого соотечественника
Презентация на тему Величие гениального творчества великого соотечественника  Измеритель концентрации асфальтенов в нефти с погружной решёткой Брэгга
Измеритель концентрации асфальтенов в нефти с погружной решёткой Брэгга Закон сохранения массы и энергии
Закон сохранения массы и энергии Презентация на тему Альдегиды (10 класс)
Презентация на тему Альдегиды (10 класс)  Основные положения о строении вещества
Основные положения о строении вещества Круговорот серы в природе
Круговорот серы в природе Лекция 26. Химическое (водородное) и электрохимическое аккумулирование энергии
Лекция 26. Химическое (водородное) и электрохимическое аккумулирование энергии Презентация на тему Химический элемент - водород
Презентация на тему Химический элемент - водород  Химическая связь и строение молекул
Химическая связь и строение молекул Sinteticheskie_Materialy_I_Ikh_Rol_1
Sinteticheskie_Materialy_I_Ikh_Rol_1 Свойства солей, оксидов, оснований
Свойства солей, оксидов, оснований Бензол (Арены )
Бензол (Арены ) Определение формул органических веществ. Задачи для самостоятельного решения
Определение формул органических веществ. Задачи для самостоятельного решения Волокна
Волокна Задача №8: Не тормози. Команда: Карбораны
Задача №8: Не тормози. Команда: Карбораны