Содержание
- 2. План: Электропроводность растворов, основные понятия Закон Кольрауша. Электропроводность органов и тканей Кондуктометрический метод исследования Потенциометрический метод
- 3. Электрохимия – раздел физической химии, изучающий закономерности химических превращений при действии электрического тока и электрических явлений
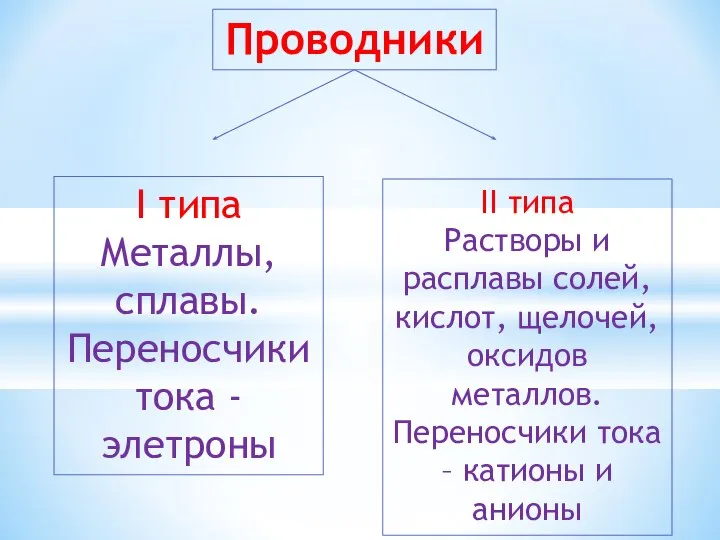
- 4. Проводники I типа Металлы, сплавы. Переносчики тока - элетроны II типа Растворы и расплавы солей, кислот,
- 5. I = U/R – связь между сопротивлением, силой тока и потенциалом. R = ρ ⋅ l/S
- 6. Электропроводность (проводимость) L = 1/R [ом-] ≡ [cм] Удельная электропроводность χ = 1/ρ χ = 1/R
- 7. Закон Кольрауша λ∞ = lK + lA при с→0 lK и lA – подвижности катиона и
- 8. Организм человека можно отнести к группе своеобразных полимеров – биополимеров, это химические соединения, состоящие из большого
- 9. Живая ткань, особенно ткань нервной системы, обладает сложнейшей комплексной электропроводностью. На практике в качестве диагностического признака
- 10. Электропунктурная диагностика (ЭПД) – метод диагностики заболеваний, основанный на измерении электропроводности биологически активных точек (БАТ). Реография
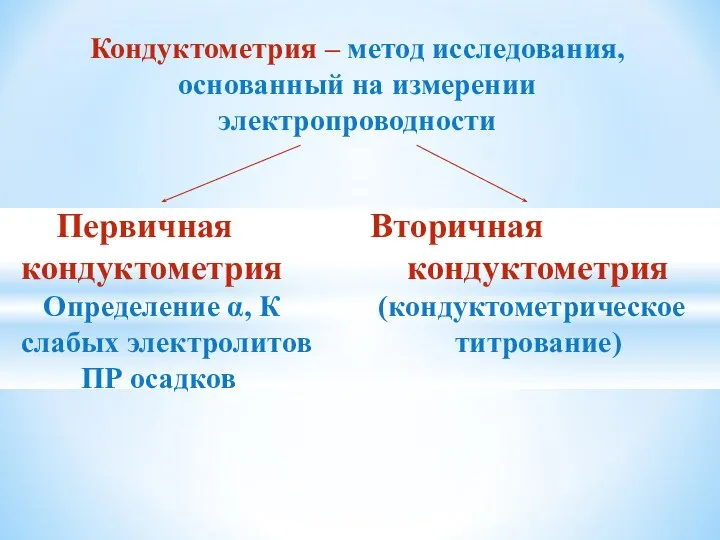
- 11. Кондуктометрия – метод исследования, основанный на измерении электропроводности Первичная Вторичная кондуктометрия кондуктометрия Определение α, К (кондуктометрическое
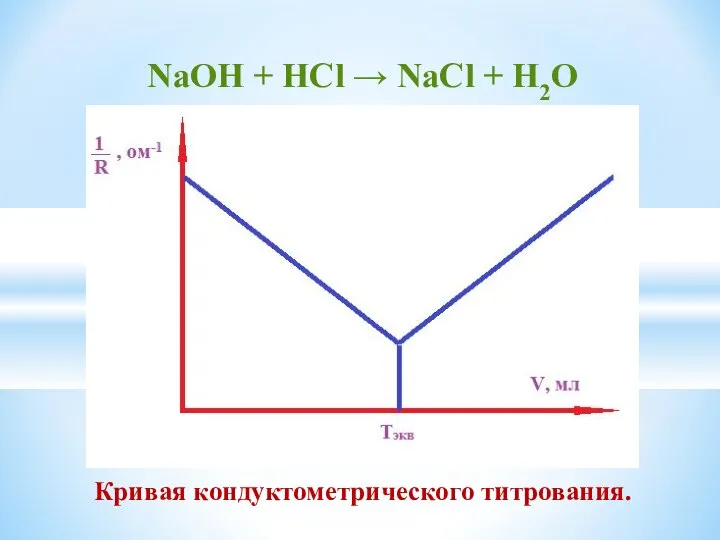
- 12. NaОН + HСl → NaCl + H2O Кривая кондуктометрического титрования.
- 13. Электрохимия изучает взаимное превращение химической энергии в электрическую и наоборот. 2 типа электрохимии Химическая Химическая энергия
- 14. В электрическую энергию можно превратить энергию только окислительно-восстановительного процесса. Гальванический элемент – это устройство, в котором
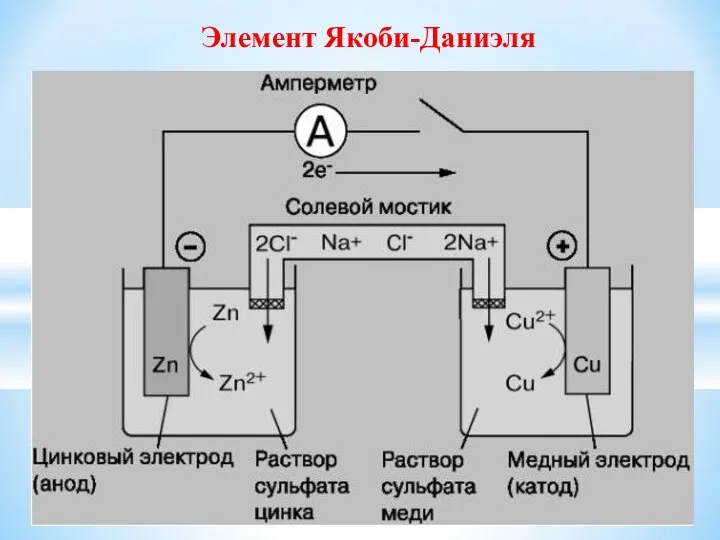
- 15. В гальваническом элементе есть: - металл (электрод) – проводник I рода - раствор электролита – проводник
- 16. Элемент Якоби-Даниэля
- 17. Работа гальванического элемента можно рассматривать как результат окислительно- восстановительной реакции Zn – 2e → Zn2+ ΔGo
- 18. ЭЛЕКТРОДЫ: Стандартный водородный 2Н+ + 2е ↔ Н2 2Н+/Н2, Е=0 (для стандартных условий) Металлические электроды Ме
- 20. Петерс развил теорию Нернста для ОВР
- 21. ЭДС = ∆Е = Ек – Еа ЭДС можно измерить в гальваническом элементе, а можно рассчитывать
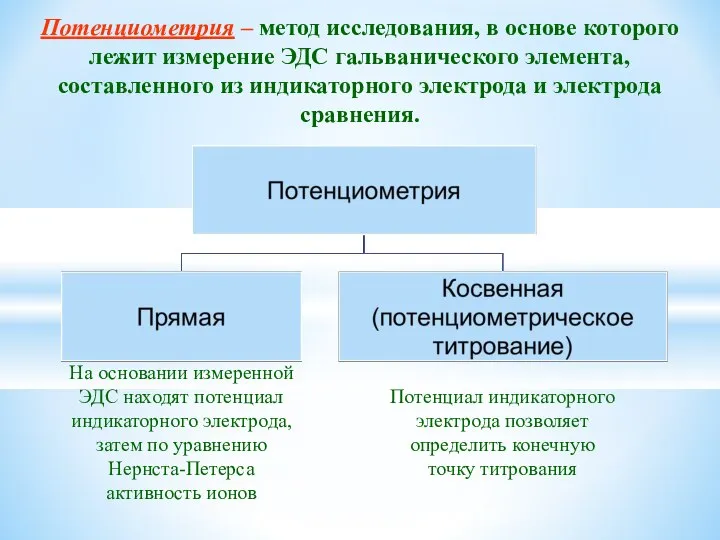
- 22. Потенциометрия – метод исследования, в основе которого лежит измерение ЭДС гальванического элемента, составленного из индикаторного электрода
- 23. Определение рН раствора гальванический элемент Для 2Н+ + 2е ↔ Н2
- 25. Скачать презентацию



![Электропроводность (проводимость) L = 1/R [ом-] ≡ [cм] Удельная электропроводность χ =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1011218/slide-5.jpg)













 Презентация на тему Нитраты и организм человека
Презентация на тему Нитраты и организм человека  Особо чистые вещества. Занятие 12
Особо чистые вещества. Занятие 12 Презентация на тему Неметаллы, особенности строения
Презентация на тему Неметаллы, особенности строения  Alkini
Alkini Соли. Классификация сложных веществ
Соли. Классификация сложных веществ Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Химическая термодинамика
Химическая термодинамика Предмет задачи, разделы, методы физической химии. Основные понятия и законы химической термодинамики
Предмет задачи, разделы, методы физической химии. Основные понятия и законы химической термодинамики Электролитическая диссоциация. Устойчивость комплексных соединений
Электролитическая диссоциация. Устойчивость комплексных соединений Значимые личности в химии
Значимые личности в химии Презентация на тему Водород (9 класс)
Презентация на тему Водород (9 класс)  Строение ячейки периодической системы Менделеева
Строение ячейки периодической системы Менделеева Презентация на тему Алмазы
Презентация на тему Алмазы  Валентность. Определение валентности по формулам
Валентность. Определение валентности по формулам Характеристика нефти и ее фракций как сырья для производства мoторныx топлив. Тема 2
Характеристика нефти и ее фракций как сырья для производства мoторныx топлив. Тема 2 Углерод. Химические свойства
Углерод. Химические свойства Кроссворд первоначальные понятия
Кроссворд первоначальные понятия агрегатные состояния вещества 7 класс
агрегатные состояния вещества 7 класс Опасные химические вещества и их поражающее действие на организм человека
Опасные химические вещества и их поражающее действие на организм человека Определение химического эквивалента, эквивалентной и атомной массы металла
Определение химического эквивалента, эквивалентной и атомной массы металла Медь
Медь Химия. 8 класс
Химия. 8 класс Презентация на тему Химия и пища
Презентация на тему Химия и пища  Расчет равновесного состояния системы натрий-кислород-водород, для энергетических ядерных реакторов
Расчет равновесного состояния системы натрий-кислород-водород, для энергетических ядерных реакторов Химия в косметике
Химия в косметике Липиды
Липиды Современные подходы к преподаванию химии
Современные подходы к преподаванию химии Взаимное притяжение и отталкивание молекул
Взаимное притяжение и отталкивание молекул