Слайд 2При химических реакциях происходит разрыв одних и образовании других связей. Поэтому химические

реакции сопровождаются выделением или поглощением энергии в виде теплоты, света, совершением работы расширения газообразных продуктов
Слайд 3Системы
Системой называют тело или группу тел, отделенных от окружающей среды реальной или

воображаемой поверхностью раздела.
В зависимости от способности системы к обмену энергией и веществом с окружающей средой различают три типа систем.
Слайд 4Внутренняя энергия
Полная энергия системы равна сумме ее кинетической энергии как целого, энергии

ее взаимодействия с внешними телами и внутренней энергии U.
Внутренняя энергия U характеризует общий энергетический запас всех компонентов (частиц) системы и включает кинетическую энергию движения молекул, атомов, ионов, электронов и других частиц и потенциальную энергию их взаимодействия.
Изменение внутренней энергии (ΔU) системы при переходе системы из одного состояния в другое можно измерить с достаточной точностью как количество энергии, принимаемой системой из окружающей среды или отдаваемой ею.
Слайд 5Процессы
Переход системы из одного состояния в другое называют процессом. Процессы бывают:
изотермические (T

= const)
изобарные (p = const)
изохорные (V = const)
Слайд 61й закон термодинамики
Сумма изменения внутренней энергии системы и совершенной системой (или над

нею) работы равна сообщенной (или выделенной) теплоте.
Слайд 7Энтальпия
Для химических реакций под работой против внешних сил обычно подразумевают работу против

внешнего давления. Для изобарных процессов она равна произведению давления p на изменение объема системы ΔV при переходе из состояния 1 в состояние 2
Н – энтальпия
А в изохорном процессе? Qv=dU
Слайд 8Вывод
Тепловой эффект химической реакции возникает в результате изменения внутренней энергии U системы

или энтальпии H
Слайд 9Термохимические расчеты
Большинство химических реакций происходит при постоянном давлении, поэтому энергетический (тепловой) эффект

реакции оценивают изменением энтальпии
Химические реакции, при протекании которых происходит уменьшение энтальпии системы (ΔH < 0) и во внешнюю среду выделяется теплота (Qp > 0), называют экзотермическими. Реакции, в результате которых энтальпия увеличивается (ΔH > 0) и система поглощает теплоту извне (Qp < 0), называют эндотермическими
Слайд 10Стандартные условия
Давление 1 бар и произвольная температура

Слайд 11Термохимические уравнения
Указывают агрегатное состояние и аллотропную модификацию реагентов и продуктов

Слайд 12Стандартное состояние вещества
Стандартное состояние вещества — наиболее устойчивое состояние при стандартных условиях.

графит, ромбическая сера, белый фосфор, кислород O2, газообразный хлор, жидкий бром
Стандартное состояние может быть отнесено к любой температуре.
Слайд 13Стандартная энтальпия образования
Стандартной энтальпией (теплотой) образования (ΔH°обр = –Q) вещества называют энтальпию

(теплоту) образования 1 моль этого вещества из простых веществ при стандартных условиях.
Согласно этому определению, энтальпия (теплота) образования простого вещества при стандартных условиях равна нулю.













 Спирты и фенолы
Спирты и фенолы V группа. Побочная подгруппа
V группа. Побочная подгруппа Природный газ, состав применение в качестве топлива
Природный газ, состав применение в качестве топлива Влияние пластифицирующих добавок на свойства декоративного мелкозернистого бетона
Влияние пластифицирующих добавок на свойства декоративного мелкозернистого бетона Молярный объем
Молярный объем Нефть: состав, свойства и переработка
Нефть: состав, свойства и переработка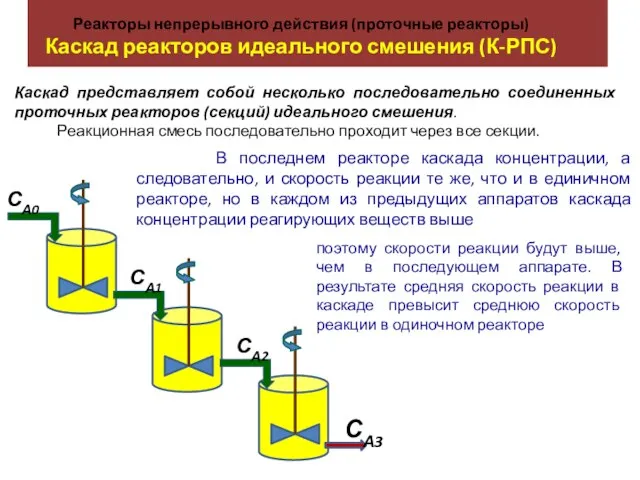 Реакторы непрерывного действия (проточные реакторы). Каскад реакторов идеального смешения (К-РПС)
Реакторы непрерывного действия (проточные реакторы). Каскад реакторов идеального смешения (К-РПС) Порядок в жидкостях
Порядок в жидкостях Когда образуется кислая соль?
Когда образуется кислая соль? Кислоты с металлами
Кислоты с металлами 8-12 химические реакции
8-12 химические реакции Физико-химические процессы в гидросфере
Физико-химические процессы в гидросфере Про задачи. Химия 11 класс
Про задачи. Химия 11 класс Мыло и синтетические моющие средства
Мыло и синтетические моющие средства Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Валентность. Определение валентности химических элементов по формуле вещества
Валентность. Определение валентности химических элементов по формуле вещества Строение электронной оболочки атома часть 2
Строение электронной оболочки атома часть 2 Презентация на тему Роль йода в организме
Презентация на тему Роль йода в организме  Кальций
Кальций Презентация по Химии "Анилин"
Презентация по Химии "Анилин" 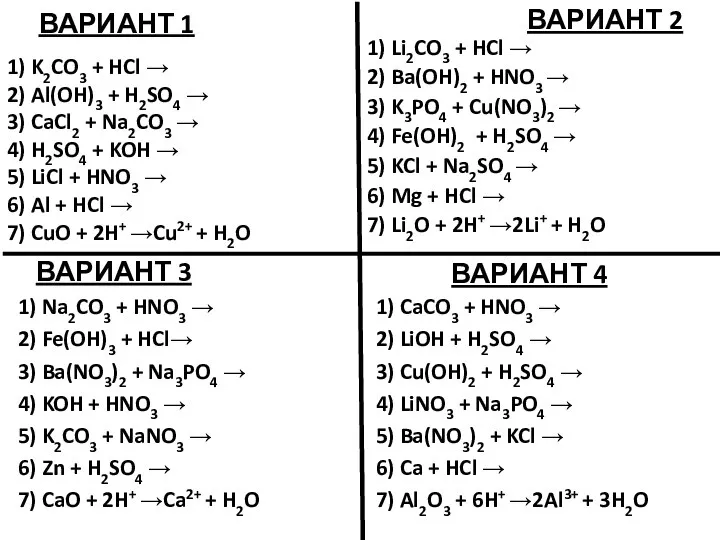 Уравнения возможных реакций. Задание
Уравнения возможных реакций. Задание Атом- сложная частица
Атом- сложная частица Фосфор
Фосфор Бутилацетат. Химическая формула бутилацетата
Бутилацетат. Химическая формула бутилацетата Презентация на тему Значение Периодического закона Д.И.Менделеева
Презентация на тему Значение Периодического закона Д.И.Менделеева  Предмет органической химии
Предмет органической химии Великие русские химики
Великие русские химики Презентация на тему Химия и повседневная жизнь человека
Презентация на тему Химия и повседневная жизнь человека