Содержание
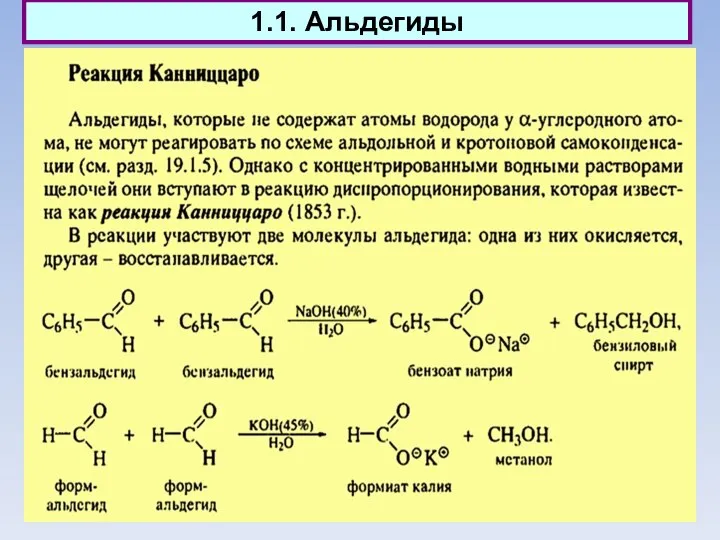
- 2. 1.1. Альдегиды
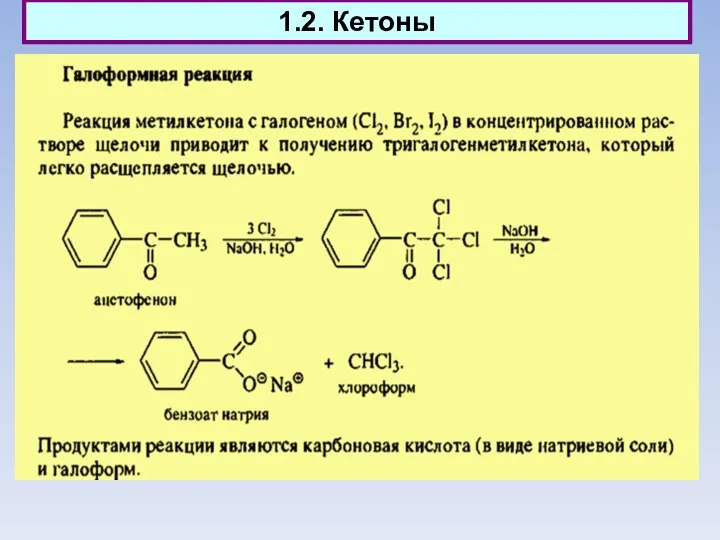
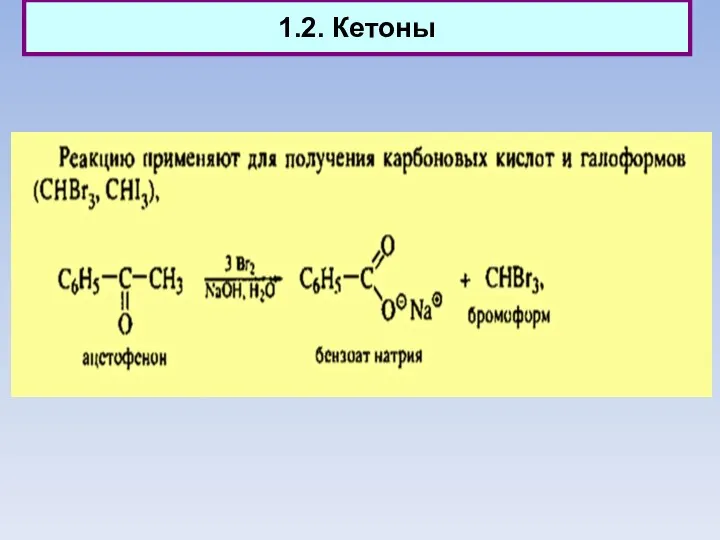
- 3. 1.2. Кетоны
- 4. 1.2. Кетоны
- 5. 1.2. Кетоны. Кетены
- 6. 1.2. Кетоны. Кетены
- 7. 1.2. Кетоны. Кетены
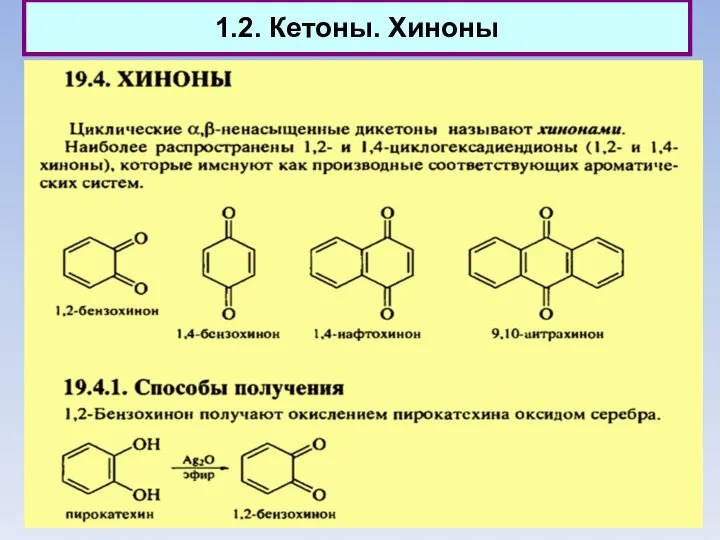
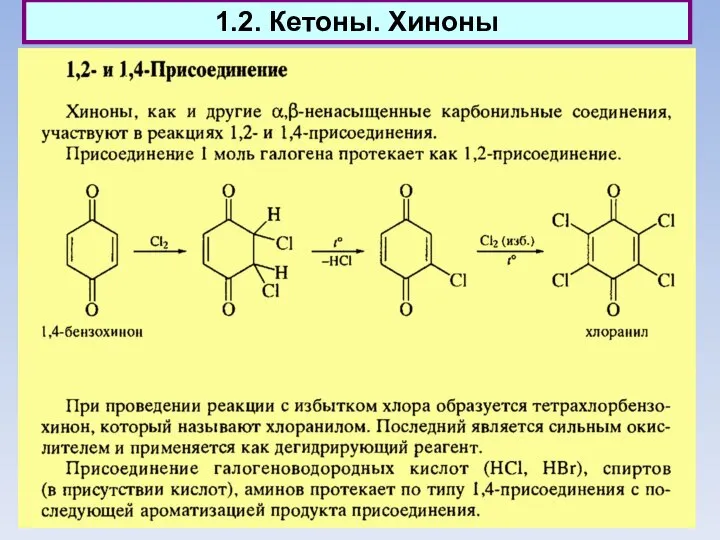
- 8. 1.2. Кетоны. Хиноны
- 9. 1.2. Кетоны. Хиноны
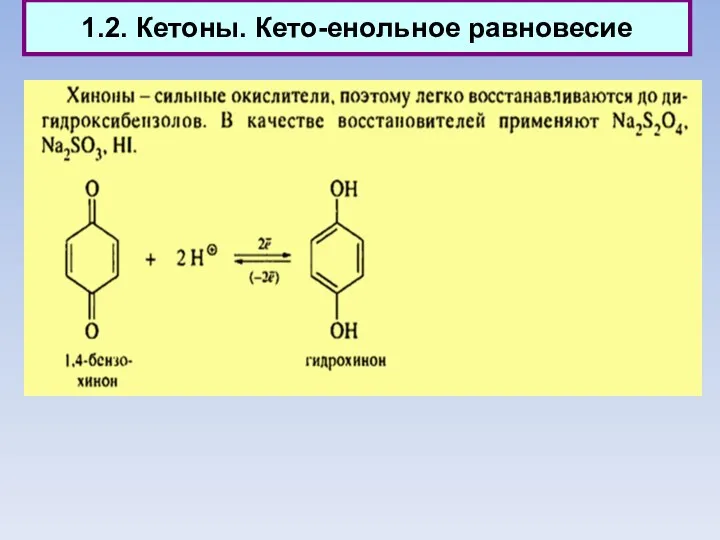
- 10. 1.2. Кетоны. Кето-енольное равновесие
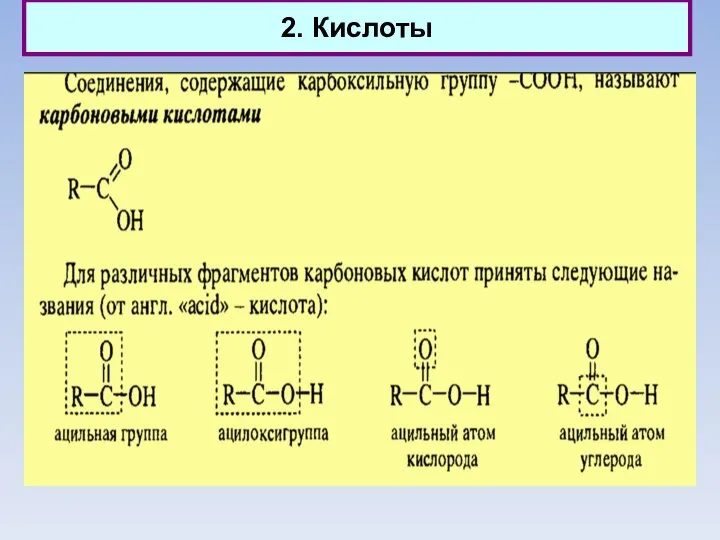
- 11. 2. Кислоты
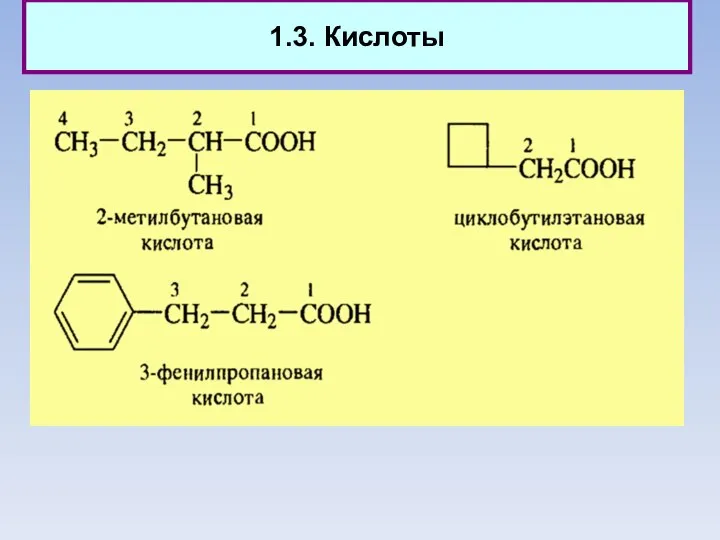
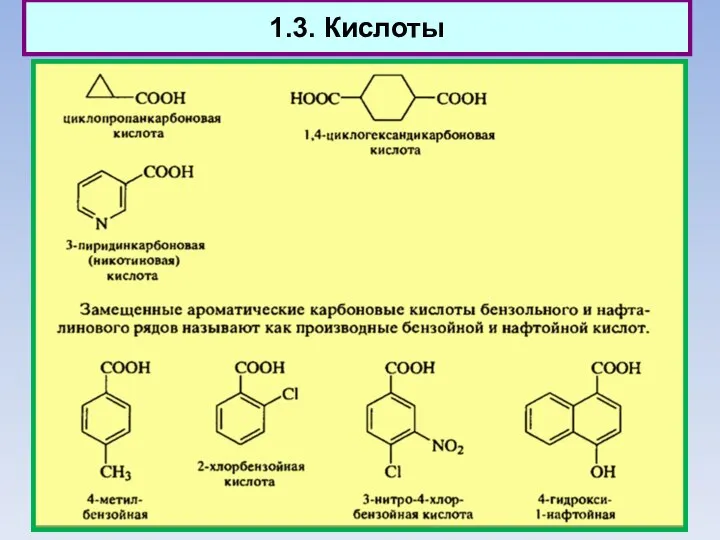
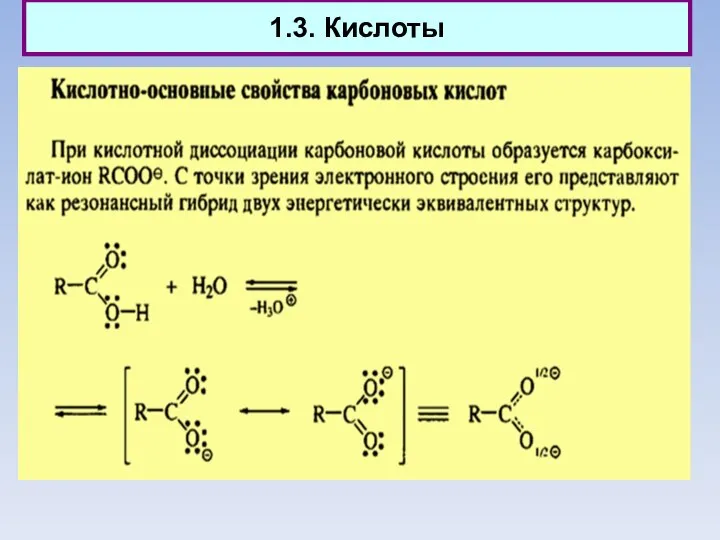
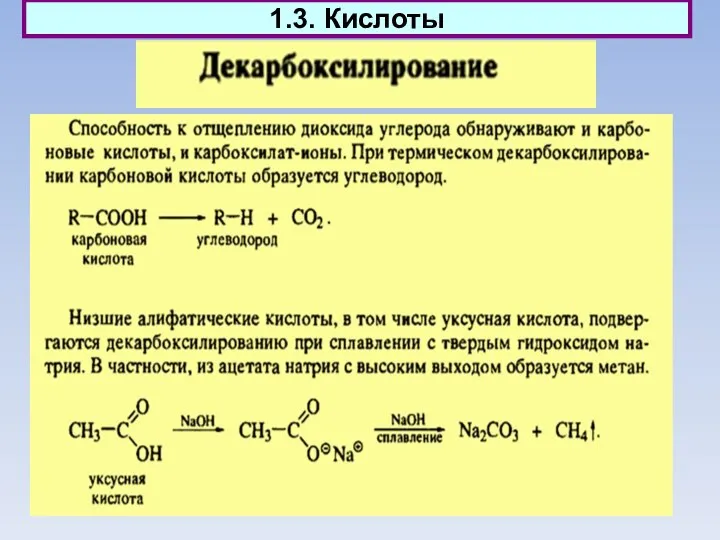
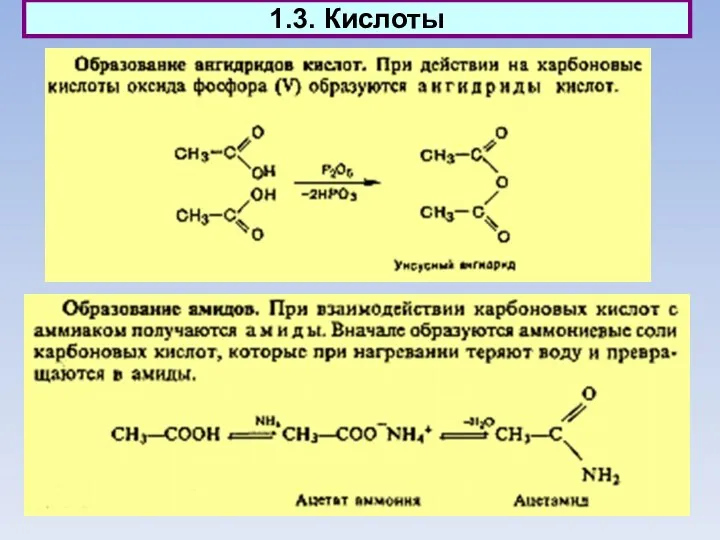
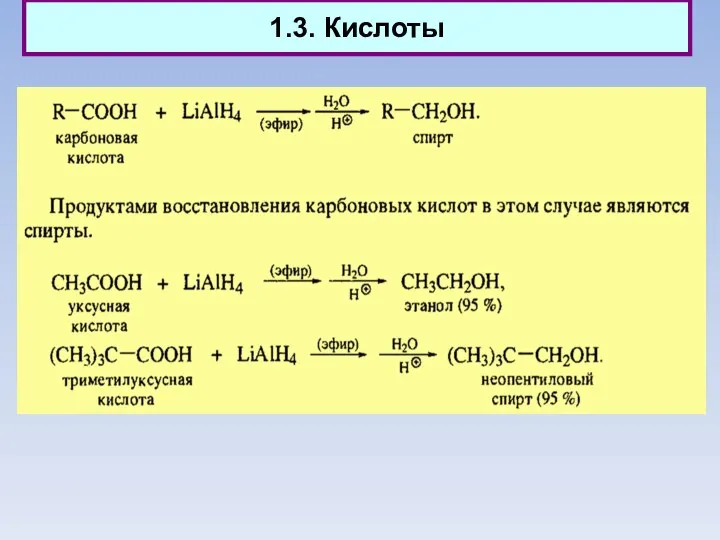
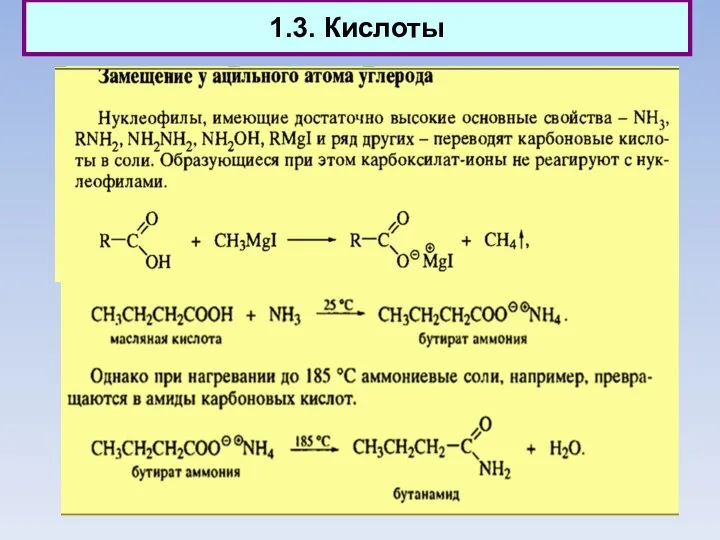
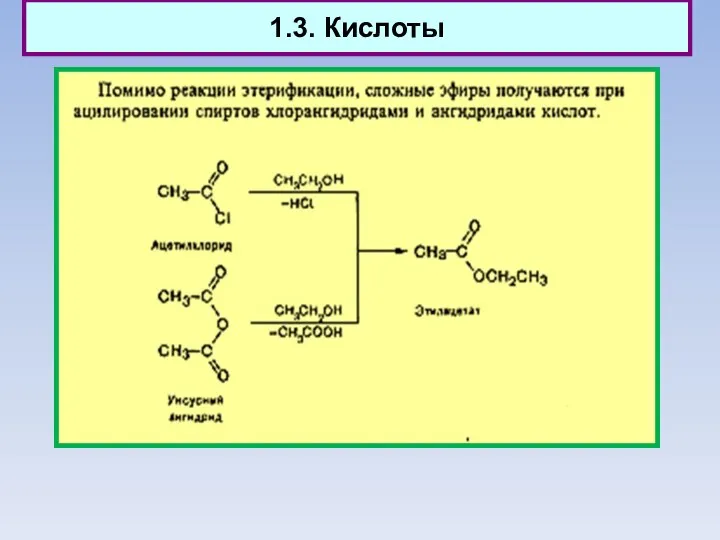
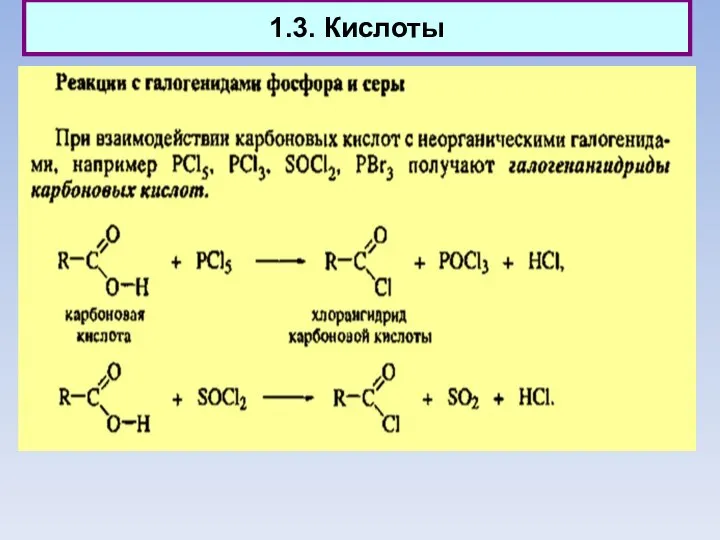
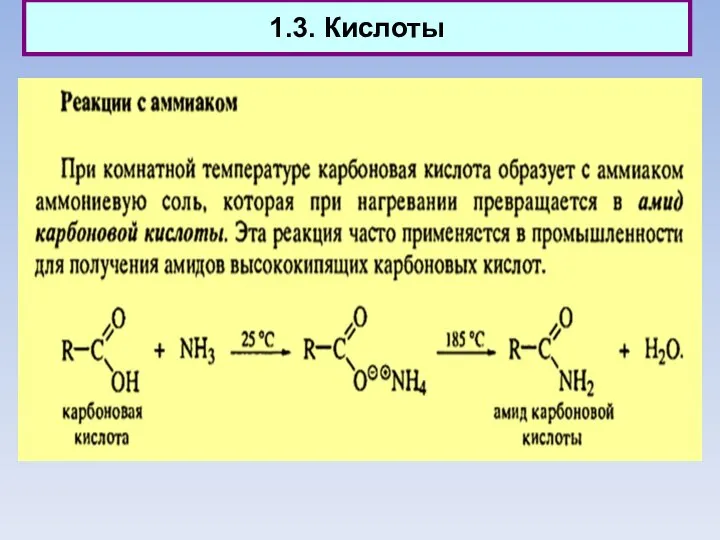
- 12. 1.3. Кислоты
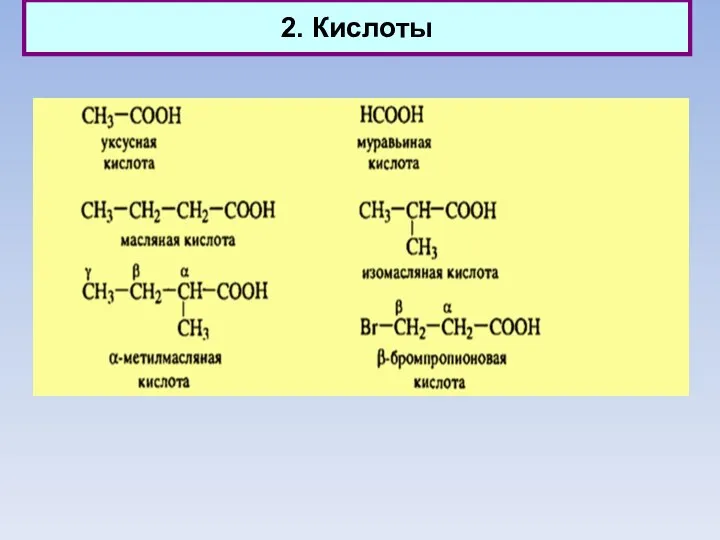
- 13. 2. Кислоты
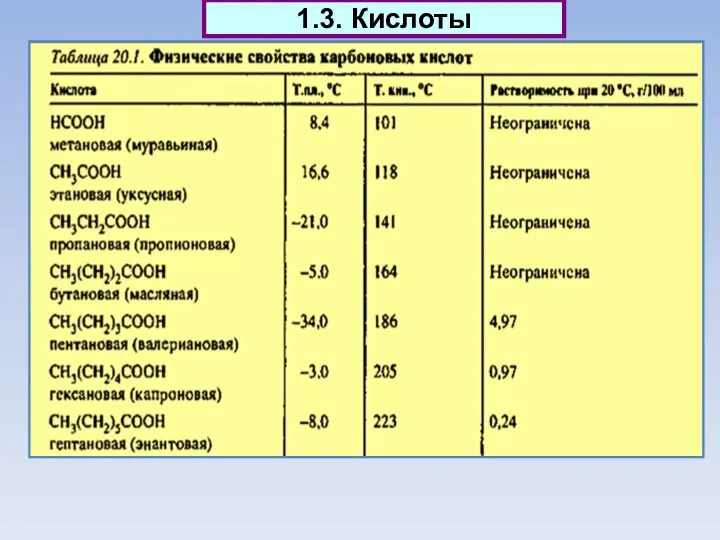
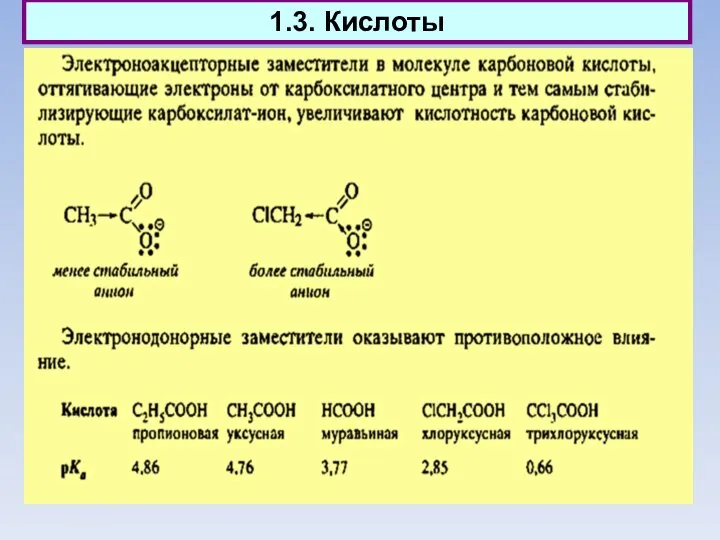
- 14. 1.3. Кислоты
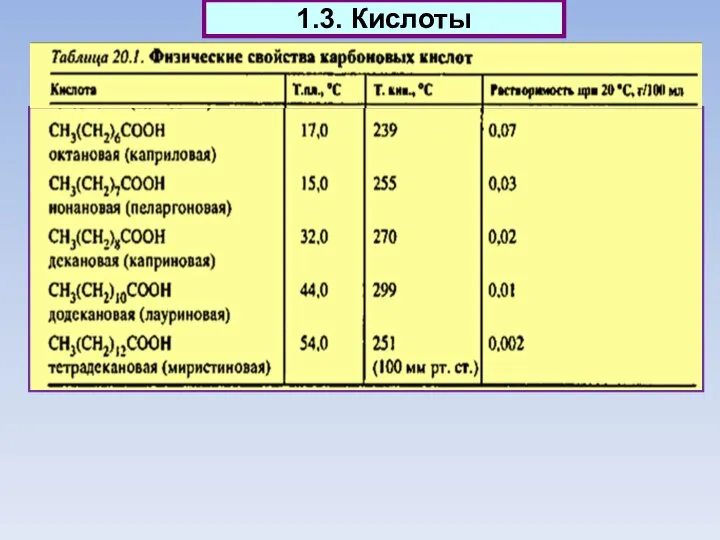
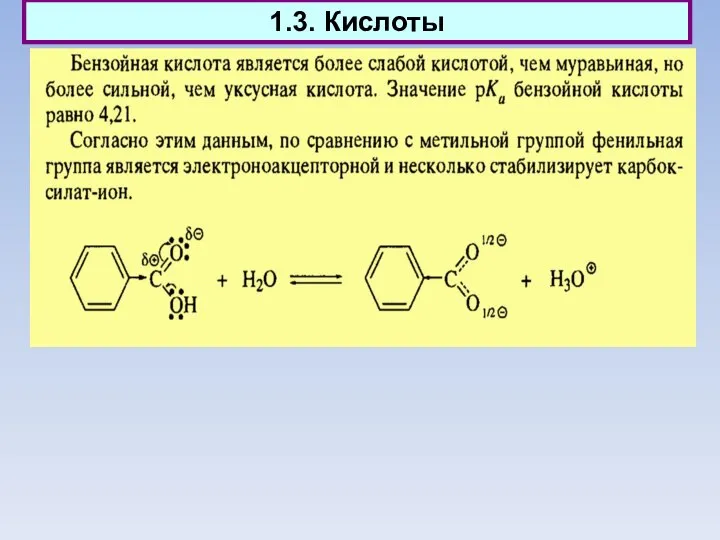
- 15. 1.3. Кислоты
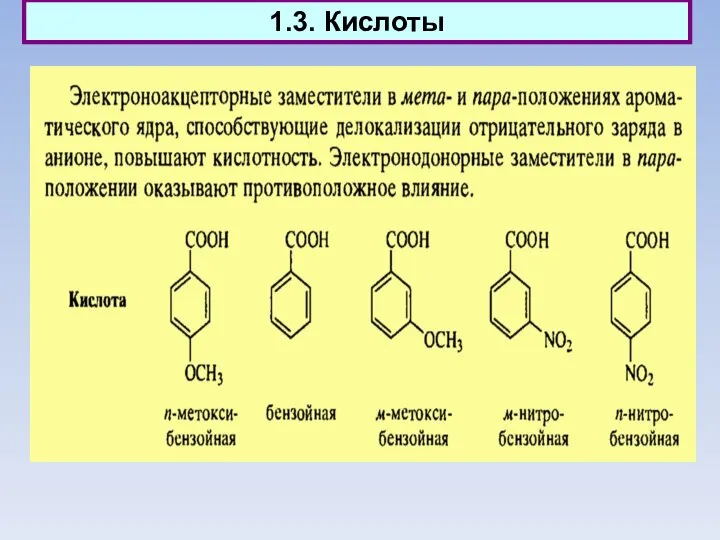
- 16. 1.3. Кислоты
- 17. 1.3. Кислоты
- 18. 1.3. Кислоты
- 19. 1.3. Кислоты
- 20. 1.3. Кислоты
- 21. 1.3. Кислоты
- 22. 1.3. Кислоты
- 23. 1.3. Кислоты
- 24. 1.3. Кислоты
- 25. 1.3. Кислоты
- 26. 1.3. Кислоты
- 27. 1.3. Кислоты
- 28. 1.3. Кислоты
- 29. 1.3. Кислоты
- 30. 1.3. Кислоты
- 31. 1.3. Кислоты
- 32. 1.3. Кислоты
- 33. 2. Биологические функции
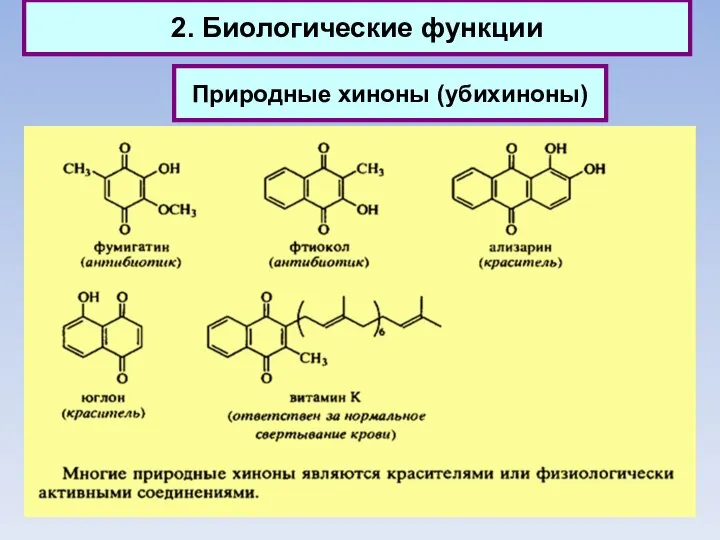
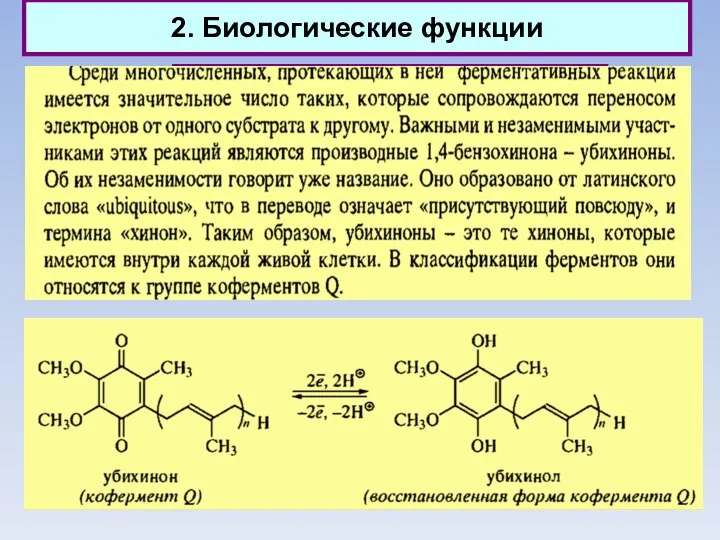
- 34. 2. Биологические функции Природные хиноны (убихиноны)
- 35. 2. Биологические функции Природные хиноны (убихиноны)
- 36. 2. Биологические функции
- 37. 2. Биологические функции
- 38. 2. Биологические функции
- 39. 2. Биологические функции
- 40. 2. Биологические функции
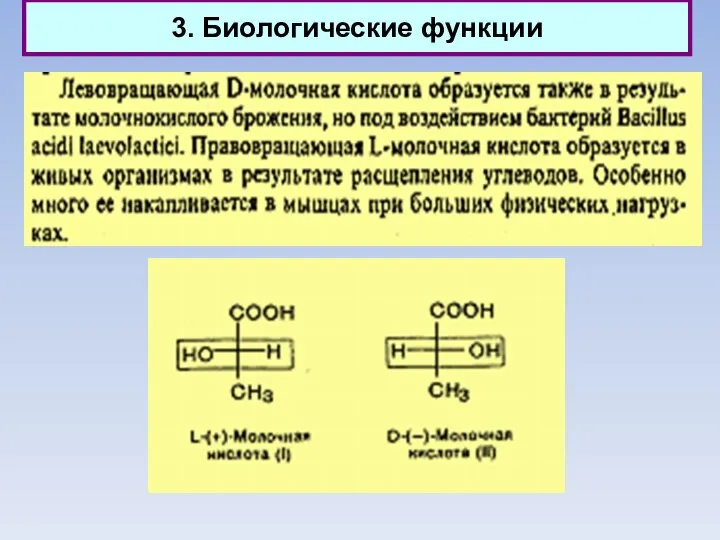
- 41. 3. Биологические функции
- 42. 3. Ароматические соединения Химические свойства Плоская структура бензола определяет многие его особенности. В последнее время выявлено
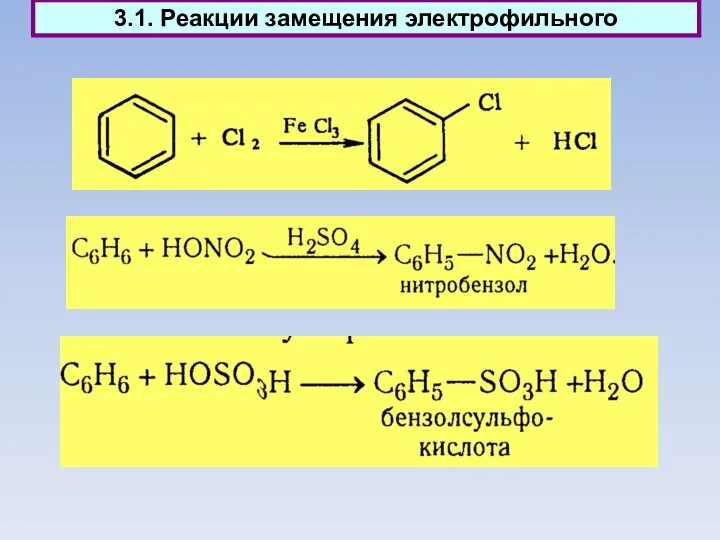
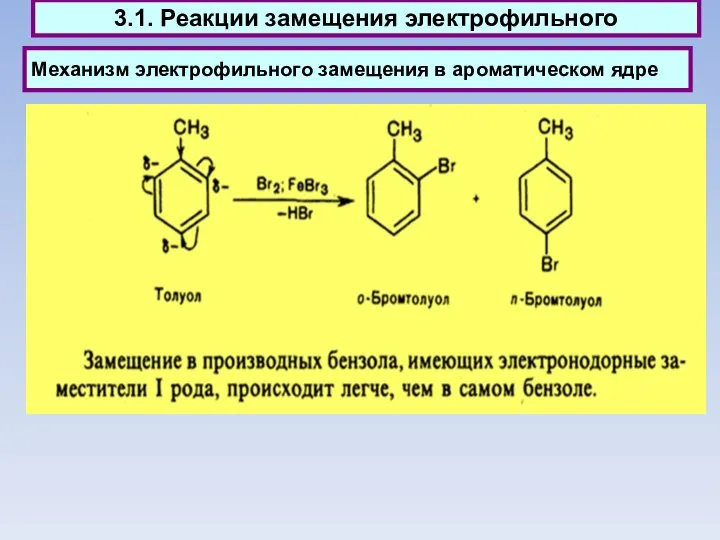
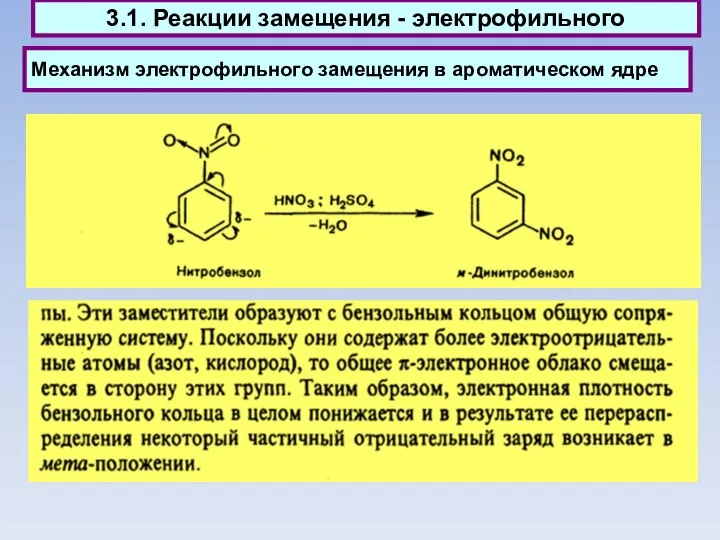
- 43. 3.1. Реакции замещения электрофильного
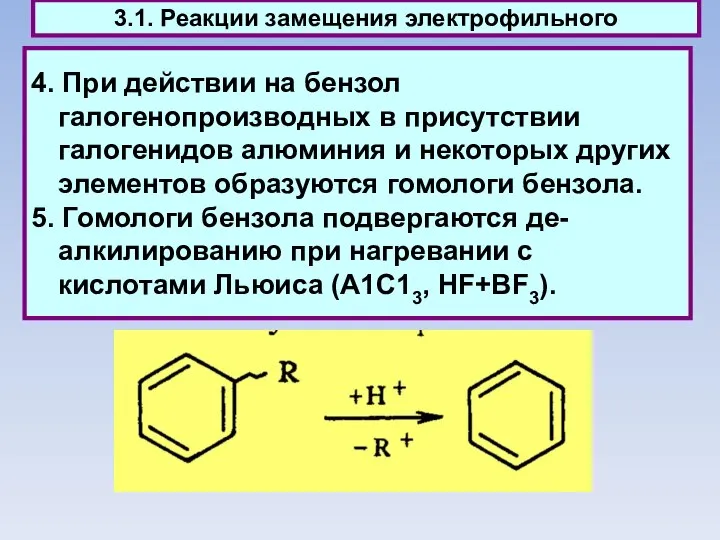
- 44. 4. При действии на бензол галогенопроизводных в присутствии галогенидов алюминия и некоторых других элементов образуются гомологи
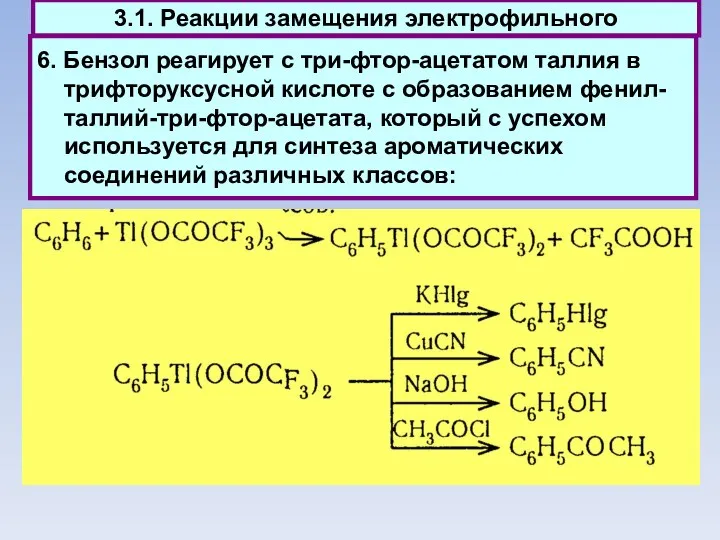
- 45. 6. Бензол реагирует с три-фтор-ацетатом таллия в трифторуксусной кислоте с образованием фенил-таллий-три-фтор-ацетата, который с успехом используется
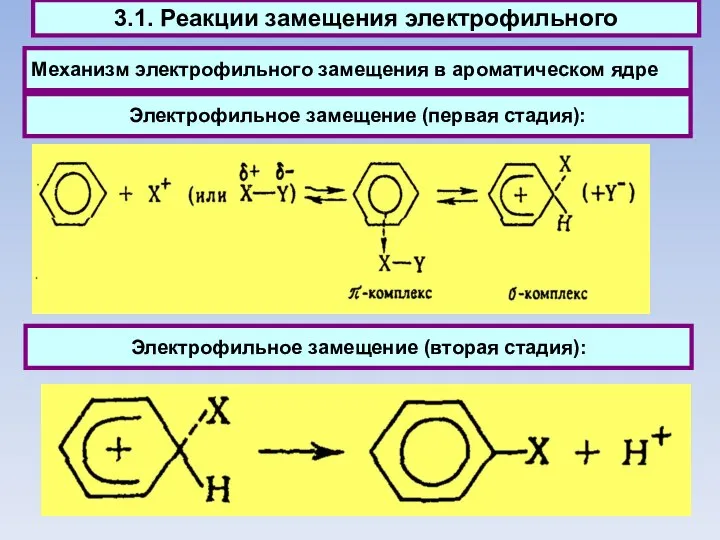
- 46. Механизм электрофильного замещения в ароматическом ядре 3.1. Реакции замещения электрофильного Электрофильное замещение (вторая стадия): Электрофильное замещение
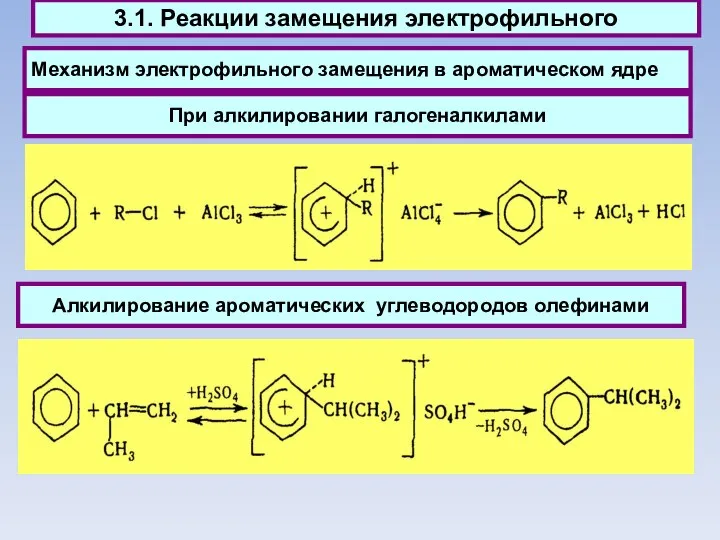
- 47. Механизм электрофильного замещения в ароматическом ядре 3.1. Реакции замещения электрофильного Алкилирование ароматических углеводородов олефинами При алкилировании
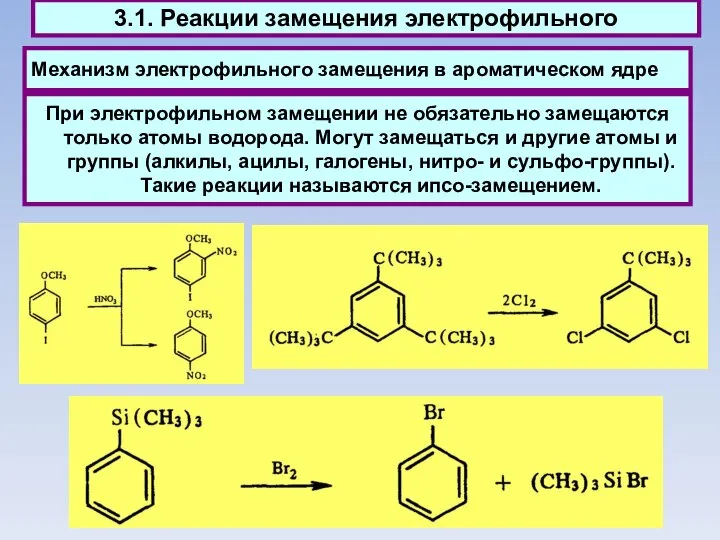
- 48. Механизм электрофильного замещения в ароматическом ядре 3.1. Реакции замещения электрофильного При электрофильном замещении не обязательно замещаются
- 49. Механизм электрофильного замещения в ароматическом ядре 3.1. Реакции замещения электрофильного
- 50. Механизм электрофильного замещения в ароматическом ядре 3.1. Реакции замещения электрофильного
- 51. Механизм электрофильного замещения в ароматическом ядре 3.1. Реакции замещения - электрофильного
- 52. Механизм электрофильного замещения в ароматическом ядре 3.1. Реакции замещения - электрофильного
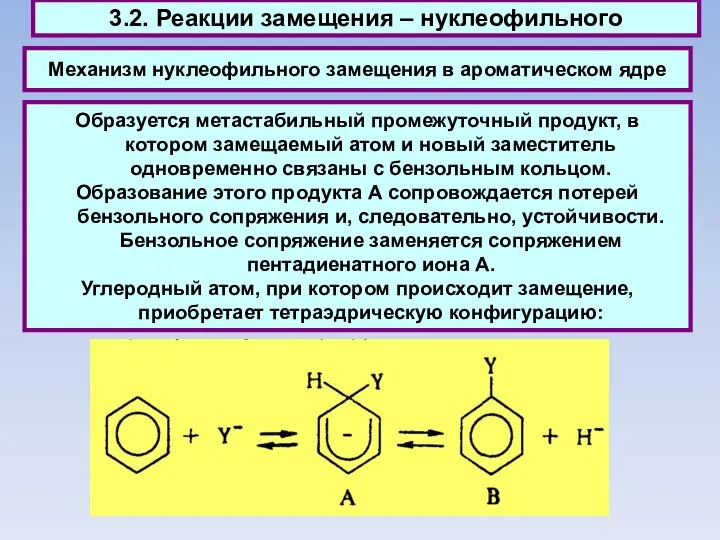
- 53. Механизм нуклеофильного замещения в ароматическом ядре 3.2. Реакции замещения – нуклеофильного Образуется метастабильный промежуточный продукт, в
- 54. 4. Биохимические функции 4.1. Циклопентановое или циклопентеновое кольца входят в состав природных веществ — простагландинов. Впервые
- 55. 4. Биохимические функции 4.1. Простагландины являются регуляторами функций клетки и обладают гормональной активностью. В отличие от
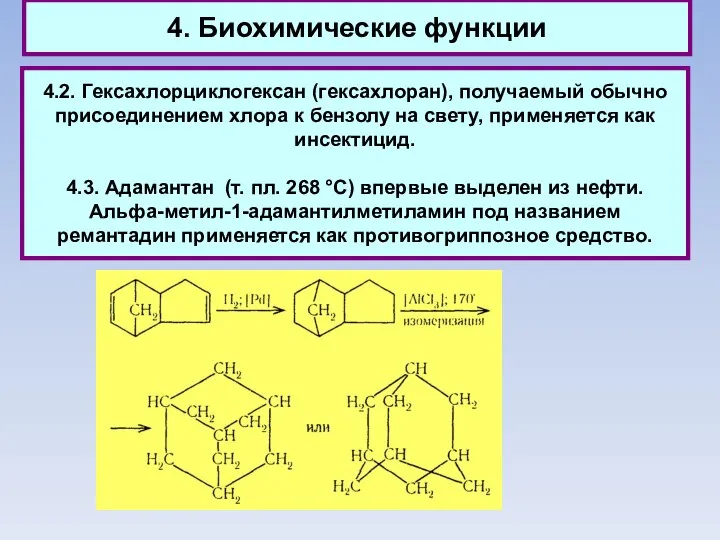
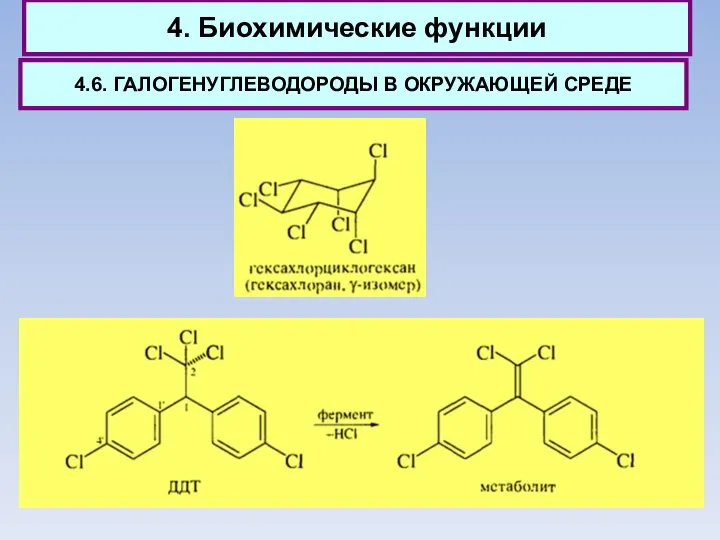
- 56. 4. Биохимические функции 4.2. Гексахлорциклогексан (гексахлоран), получаемый обычно присоединением хлора к бензолу на свету, применяется как
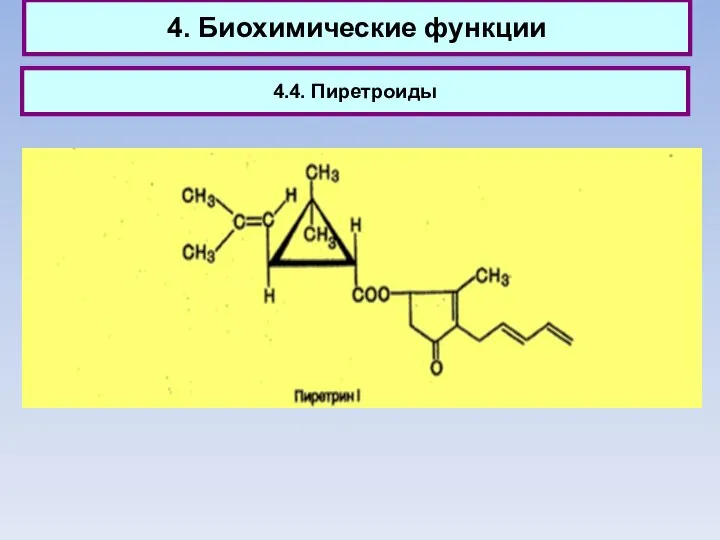
- 57. 4. Биохимические функции 4.4. Пиретроиды
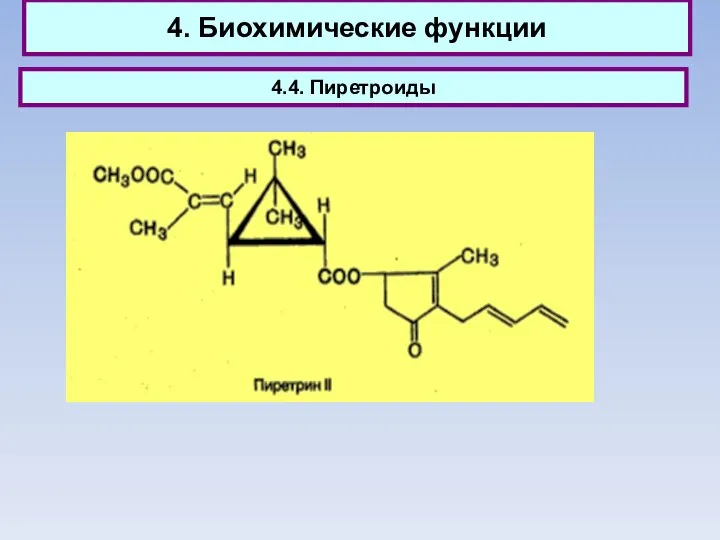
- 58. 4. Биохимические функции 4.4. Пиретроиды
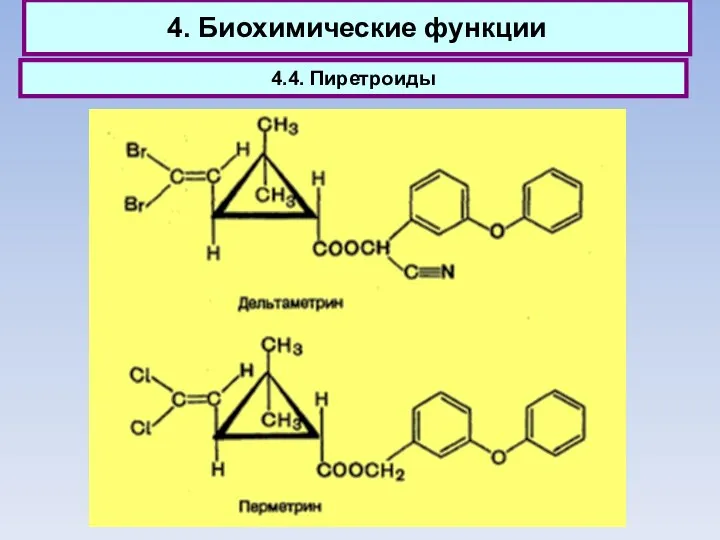
- 59. 4. Биохимические функции 4.4. Пиретроиды
- 60. 4. Биохимические функции 4.4. Пиретроиды
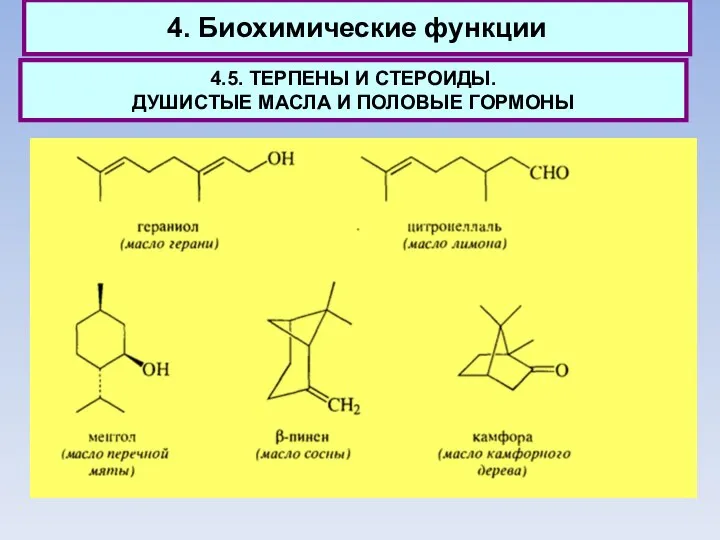
- 61. 4. Биохимические функции 4.5. ТЕРПЕНЫ И СТЕРОИДЫ. ДУШИСТЫЕ МАСЛА И ПОЛОВЫЕ ГОРМОНЫ Количество компонентов, образующих душистое
- 62. 4. Биохимические функции 4.5. ТЕРПЕНЫ И СТЕРОИДЫ. ДУШИСТЫЕ МАСЛА И ПОЛОВЫЕ ГОРМОНЫ
- 63. 4. Биохимические функции 4.5. ТЕРПЕНЫ И СТЕРОИДЫ. ДУШИСТЫЕ МАСЛА И ПОЛОВЫЕ ГОРМОНЫ
- 64. 4. Биохимические функции 4.5. ТЕРПЕНЫ И СТЕРОИДЫ. ДУШИСТЫЕ МАСЛА И ПОЛОВЫЕ ГОРМОНЫ
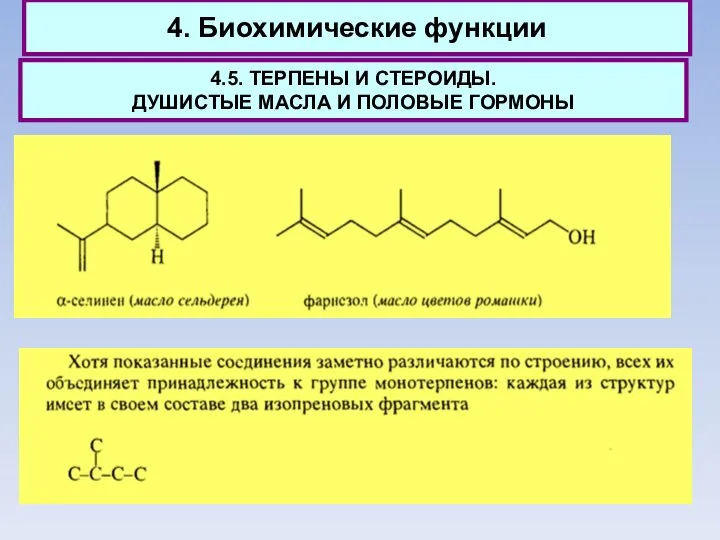
- 65. 4. Биохимические функции 4.5. ТЕРПЕНЫ И СТЕРОИДЫ. ДУШИСТЫЕ МАСЛА И ПОЛОВЫЕ ГОРМОНЫ Все названные терпеноиды являются
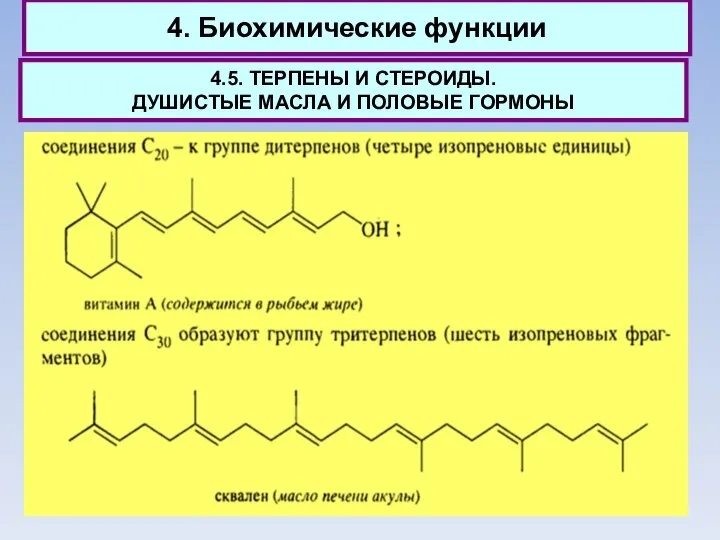
- 66. 4. Биохимические функции 4.5. ТЕРПЕНЫ И СТЕРОИДЫ. ДУШИСТЫЕ МАСЛА И ПОЛОВЫЕ ГОРМОНЫ В наибольшем количестве в
- 67. 4. Биохимические функции 4.5. ТЕРПЕНЫ И СТЕРОИДЫ. ДУШИСТЫЕ МАСЛА И ПОЛОВЫЕ ГОРМОНЫ
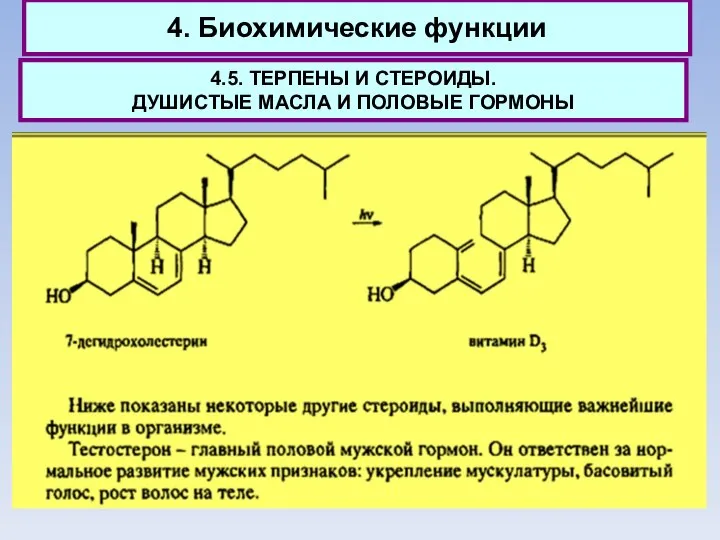
- 68. 4. Биохимические функции 4.5. ТЕРПЕНЫ И СТЕРОИДЫ. ДУШИСТЫЕ МАСЛА И ПОЛОВЫЕ ГОРМОНЫ
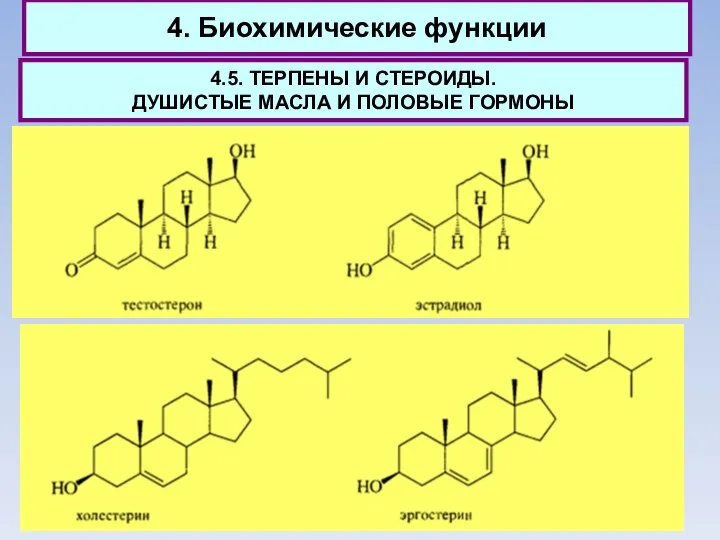
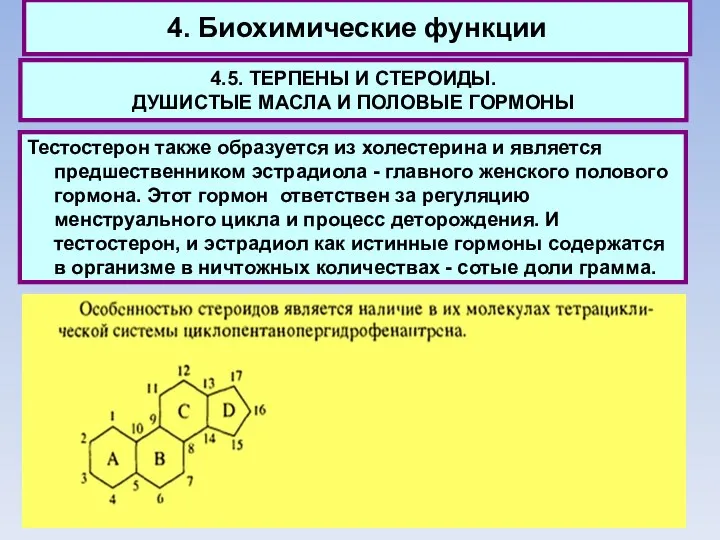
- 69. 4. Биохимические функции 4.5. ТЕРПЕНЫ И СТЕРОИДЫ. ДУШИСТЫЕ МАСЛА И ПОЛОВЫЕ ГОРМОНЫ Тестостерон также образуется из
- 70. 4. Биохимические функции 4.5. ТЕРПЕНЫ И СТЕРОИДЫ. ДУШИСТЫЕ МАСЛА И ПОЛОВЫЕ ГОРМОНЫ Подчеркивая несомненную ценность холестерина
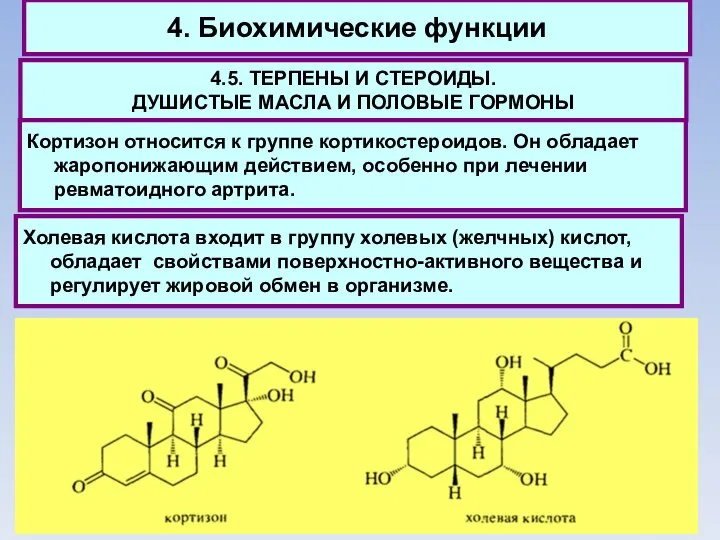
- 71. 4. Биохимические функции 4.5. ТЕРПЕНЫ И СТЕРОИДЫ. ДУШИСТЫЕ МАСЛА И ПОЛОВЫЕ ГОРМОНЫ Кортизон относится к группе
- 72. 4. Биохимические функции 4.6. ГАЛОГЕНУГЛЕВОДОРОДЫ В ОКРУЖАЮЩЕЙ СРЕДЕ Галогенпроизводные углеводородов с большим трудом подвергаются в природе
- 73. 4. Биохимические функции 4.6. ГАЛОГЕНУГЛЕВОДОРОДЫ В ОКРУЖАЮЩЕЙ СРЕДЕ
- 74. 4. Биологические функции
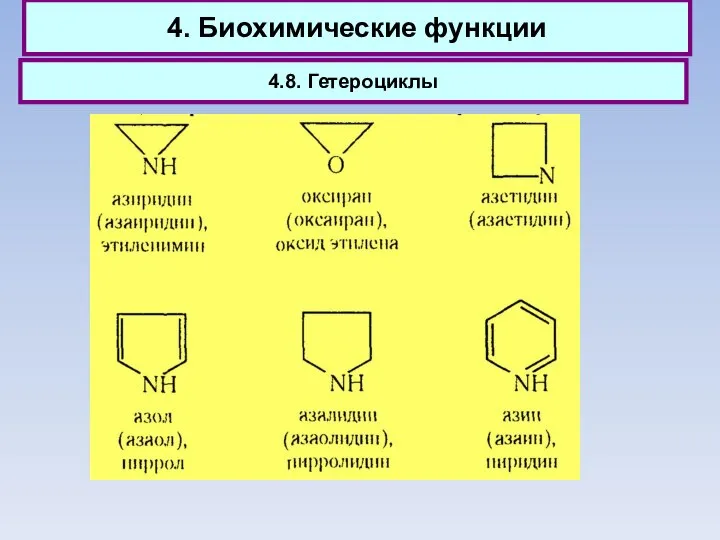
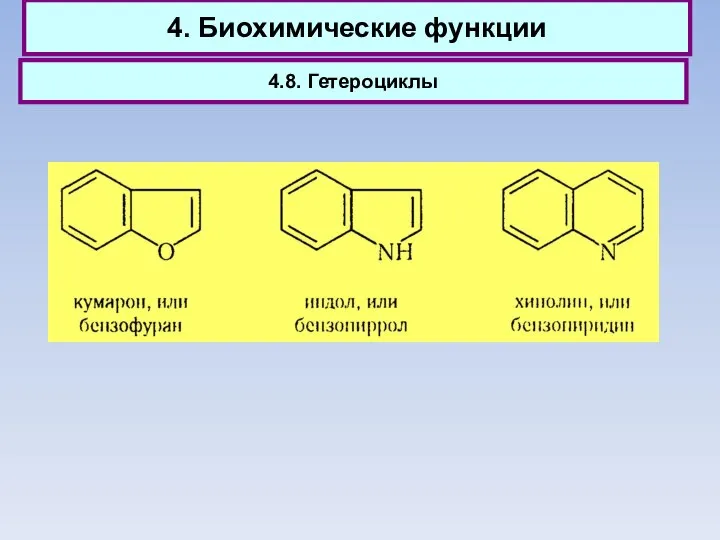
- 75. 4. Биохимические функции 4.8. Гетероциклы
- 76. 4. Биохимические функции 4.8. Гетероциклы
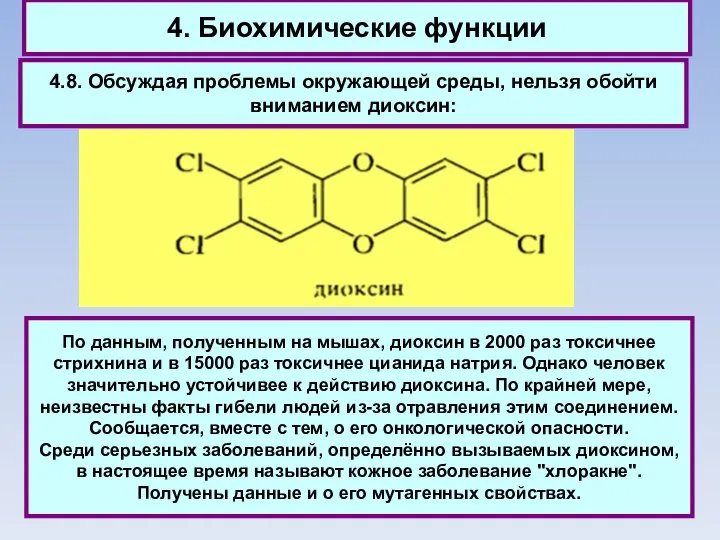
- 77. 4. Биохимические функции 4.8. Обсуждая проблемы окружающей среды, нельзя обойти вниманием диоксин: По данным, полученным на
- 78. 4. Биохимические функции 4.8. Гетероциклы Фуран, тиофен и пиррол — бесцветные жидкости, практически нерастворимые в воде.
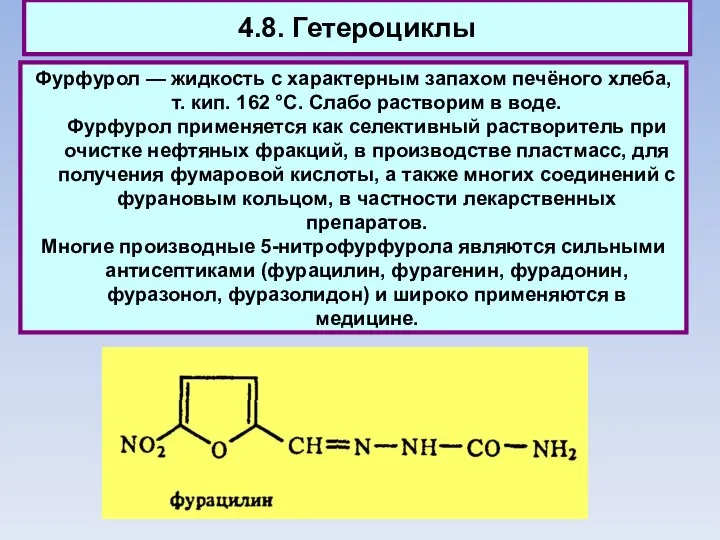
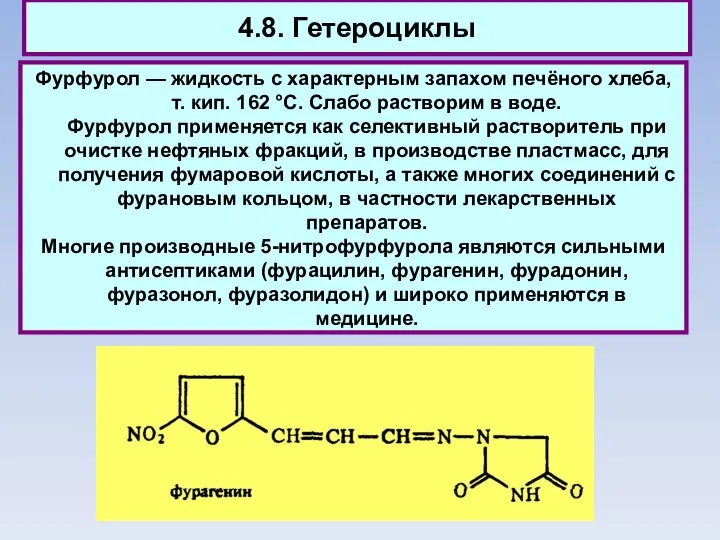
- 79. 4.8. Гетероциклы Фурфурол — жидкость с характерным запахом печёного хлеба, т. кип. 162 °С. Слабо растворим
- 80. 4.8. Гетероциклы Фурфурол — жидкость с характерным запахом печёного хлеба, т. кип. 162 °С. Слабо растворим
- 81. 4.8. Гетероциклы Интерес к химии тиофена возродился в недавние годы в связи с тем, что некоторые
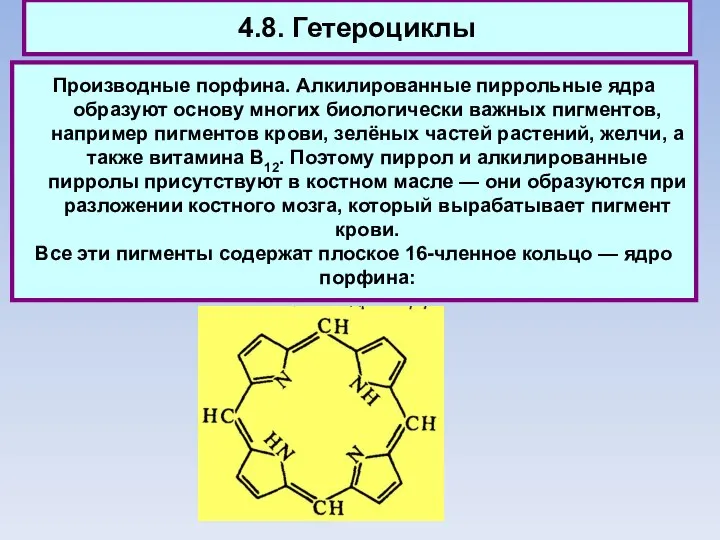
- 82. 4.8. Гетероциклы Производные порфина. Алкилированные пиррольные ядра образуют основу многих биологически важных пигментов, например пигментов крови,
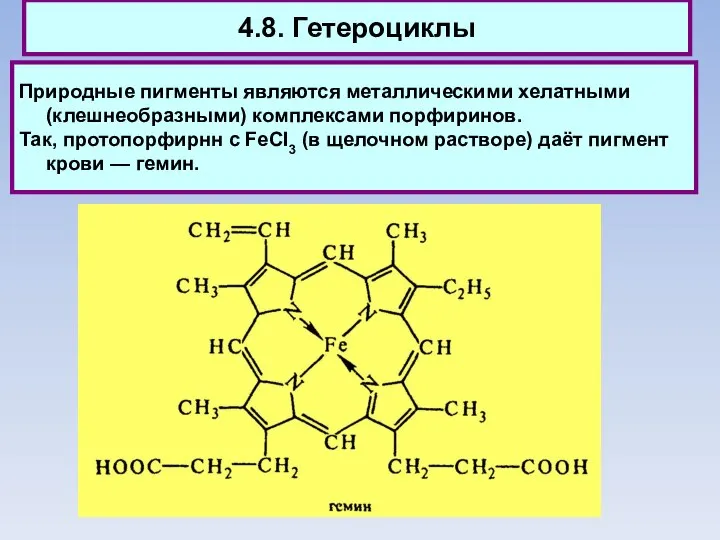
- 83. 4.8. Гетероциклы Природные пигменты являются металлическими хелатными (клешнеобразными) комплексами порфиринов. Так, протопорфирнн с FeCI3 (в щелочном
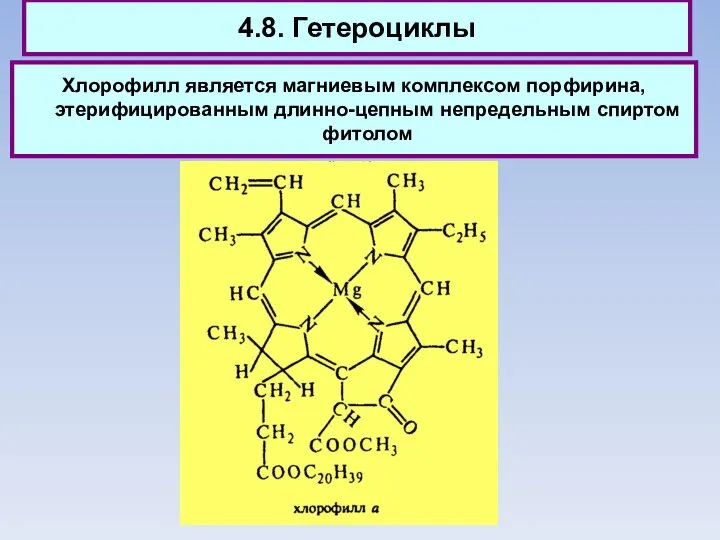
- 84. 4.8. Гетероциклы Хлорофилл является магниевым комплексом порфирина, этерифицированным длинно-цепным непредельным спиртом фитолом
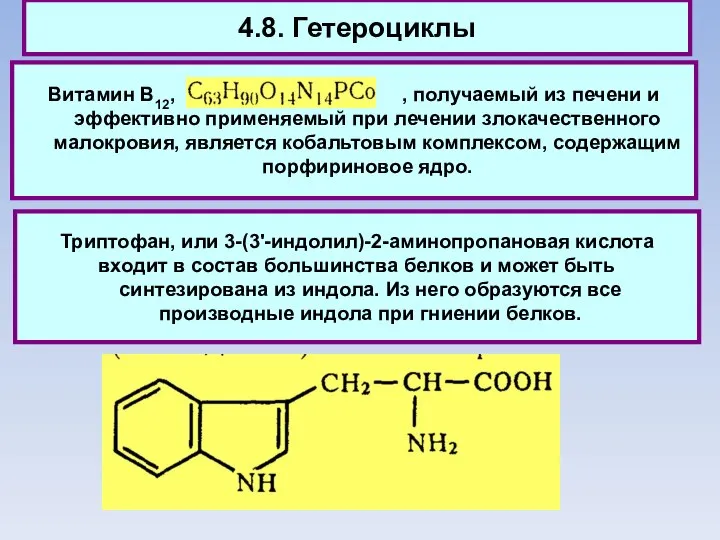
- 85. 4.8. Гетероциклы Витамин В12, , получаемый из печени и эффективно применяемый при лечении злокачественного малокровия, является
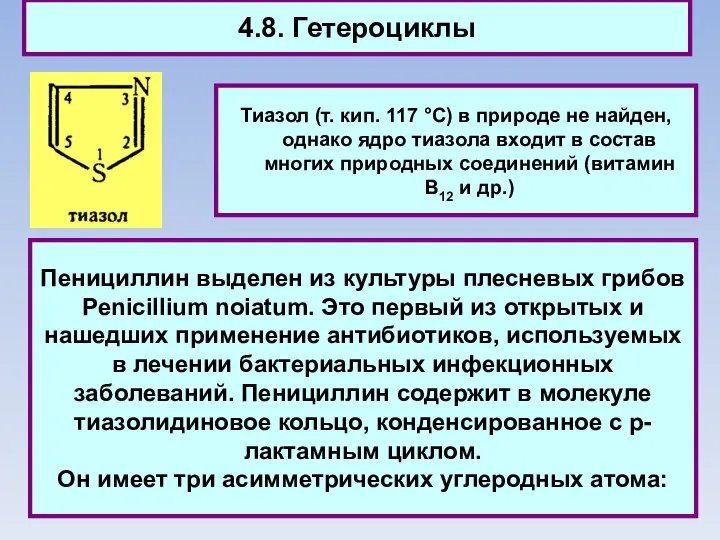
- 86. 4.8. Гетероциклы Тиазол (т. кип. 117 °C) в природе не найден, однако ядро тиазола входит в
- 87. 4.8. Гетероциклы Алкалоиды Производными пиридина и пиперидина являются некоторые представители большой группы природных веществ основного характера
- 88. 4.8. Гетероциклы Алкалоиды Большинство изученных алкалоидов имеет в своей основе более или менее сложно построенные гетероциклические
- 89. 4. Биологические функции
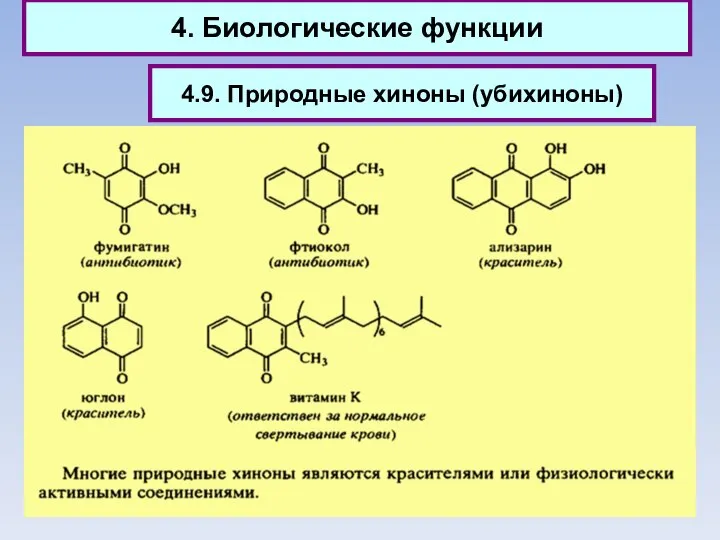
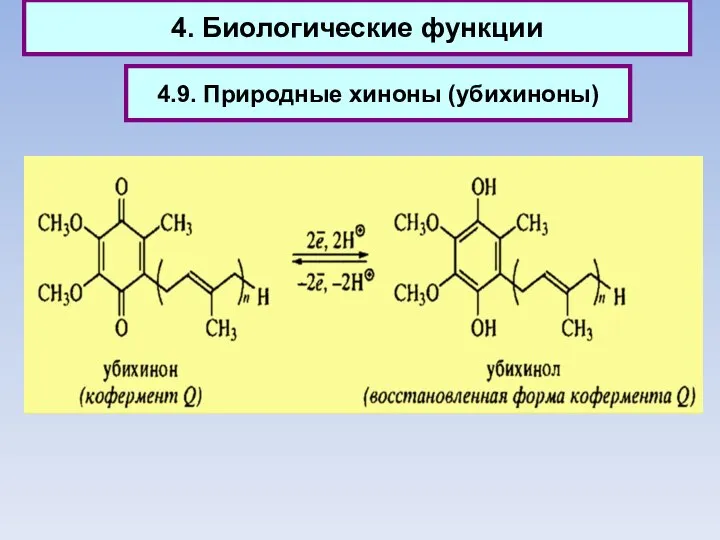
- 90. 4. Биологические функции 4.9. Природные хиноны (убихиноны)
- 91. 4. Биологические функции Природные хиноны (убихиноны)
- 92. 4. Биологические функции 4.9. Природные хиноны (убихиноны)
- 93. 4. Биологические функции
- 94. 4. Биологические функции
- 96. Скачать презентацию


































 Предмет органическая химия. Теория строения органических веществ
Предмет органическая химия. Теория строения органических веществ Презентация на тему Количество вещества. Молярная масса
Презентация на тему Количество вещества. Молярная масса  Сложные эфиры. Жиры. Мыла
Сложные эфиры. Жиры. Мыла Металлы
Металлы ОВ. Структура и принцип работы параметры ОВ
ОВ. Структура и принцип работы параметры ОВ Химическое равновесие
Химическое равновесие Template biosynthesis
Template biosynthesis Bool-doser team
Bool-doser team Хромопротеиды (от. греч. chroma — цвет, окраска + протеиды)
Хромопротеиды (от. греч. chroma — цвет, окраска + протеиды) Введение в аналитическую химию
Введение в аналитическую химию Кислород. 8 класс
Кислород. 8 класс Соединения галогенов
Соединения галогенов Презентация на тему Лекарства
Презентация на тему Лекарства  Электролиз растворов и расплавов
Электролиз растворов и расплавов Опис технологічного процесу отримання смол бекелітових рідких марок
Опис технологічного процесу отримання смол бекелітових рідких марок Периодическая система химических элементов Д. И. Менделеева
Периодическая система химических элементов Д. И. Менделеева Алкены
Алкены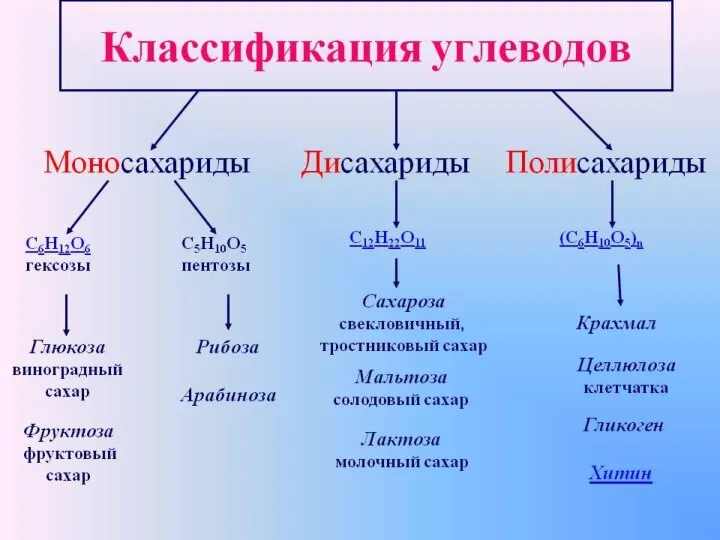 Классификация углеродов
Классификация углеродов Презентация по химии на тему _Высокомолекулярные Соединения_ (1)
Презентация по химии на тему _Высокомолекулярные Соединения_ (1) Хроматография. Особенности метода хроматографии
Хроматография. Особенности метода хроматографии Строение и свойства алканов
Строение и свойства алканов Кислотность почв с.Берёзовка МОУ «СОШ с.Берёзовка» Колесников Иван, 9 класс Пряхина Виктория, 8 класс
Кислотность почв с.Берёзовка МОУ «СОШ с.Берёзовка» Колесников Иван, 9 класс Пряхина Виктория, 8 класс Номенклатура органических соединений
Номенклатура органических соединений Карбонильные соединения. (Лекция 10)
Карбонильные соединения. (Лекция 10) Физические свойства полупроводников
Физические свойства полупроводников Анализ углеводов в пищевых продуктах
Анализ углеводов в пищевых продуктах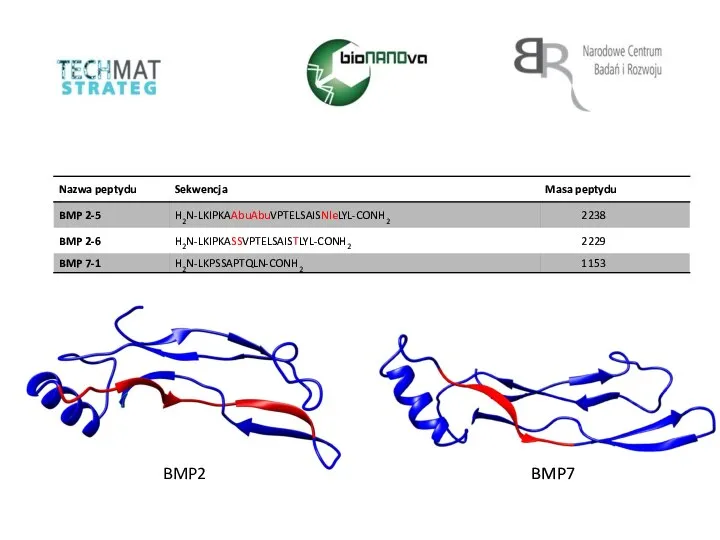 Nazwa peptydu. Sekwencja
Nazwa peptydu. Sekwencja Серная кислота
Серная кислота