Содержание
- 2. Цели урока: Изучить химические реакции, признаки и условия их протекания, познакомиться с экзо- и эндотермическими реакциями.
- 3. Физические и химические явления Явление – это любое изменение, происходящее с веществом. Физические явления – изменения,
- 4. Химические реакции Реагенты – вещества, которые вступают в реакцию. Продукты – вещества, которые образуются в результате
- 5. Признаки химических реакций
- 6. Условия протекания химических реакций 1.Изменение температуры (нагревание/охлаждение). 2. Изменение давление (уменьшение/увеличение). 3. Соприкосновение, перемещение. 4. Измельчение.
- 7. Классификация По числу и составу реагирующих веществ По изменению степени окисления химических элементов, образующих вещества По
- 8. По числу и составу реагирующих веществ Реакции, идущие без изменения состава веществ Реакции, идущие с изменением
- 9. По изменению степени окисления Окислительно-восстановительные Реакции, идущие без изменения степеней окисления химических элементов
- 10. По тепловому эффекту Экзотермические Эндотермические
- 11. По агрегатному состоянию реагирующих веществ Гомогенные Гетерогенные
- 12. По участию катализатора Каталитические Некаталитические
- 13. По направлению Необратимые Обратимые
- 14. Без изменения состава вещества Получение аллотропных модификаций C (графит) C (алмаз)
- 15. С изменением состава Соединения Разложения Замещения Обмена
- 16. Реакции соединения – из двух и более веществ образуется одно более сложное 2H2 + O2 2H2O
- 17. Реакции разложения – из одного вещества образуется два и более 2HgO 2Hg + O2 2KNO3 2KNO2
- 18. Реакции замещения – атомы простого вещества замещают атомы в сложном веществе Mg + 2HCl MgCl2 +
- 19. Реакции обмена – вещества обмениваются своими составными частями CO2+Ca(OH)2 CaCO3 +H2O K2S + 2HCl H2S +
- 20. Окислительно-восстановительные реакции 0 0 +4 -2 C + O2 CO2 0 +4 C – 4e C
- 21. Реакции протекающие без изменения степени окисления + -2 + -2 + -2 + Li2O + H2O
- 22. Экзотермические - реакции протекающие с выделением теплоты 4P + 5O2 2P2O5 + Q CH4+2O2 CO2+2H2O +
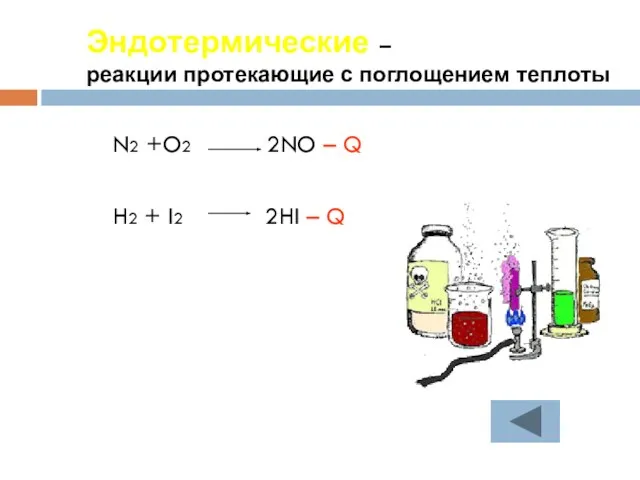
- 23. Эндотермические – реакции протекающие с поглощением теплоты N2 +O2 2NO – Q H2 + I2 2HI
- 24. Гомогенные – реакции в которых исходные вещества и продукты реакции находятся в одном агрегатном состоянии H2
- 25. Гетерогенные - реакции в которых исходные вещества и продукты реакции находятся в разных агрегатных состояниях Ca(т)
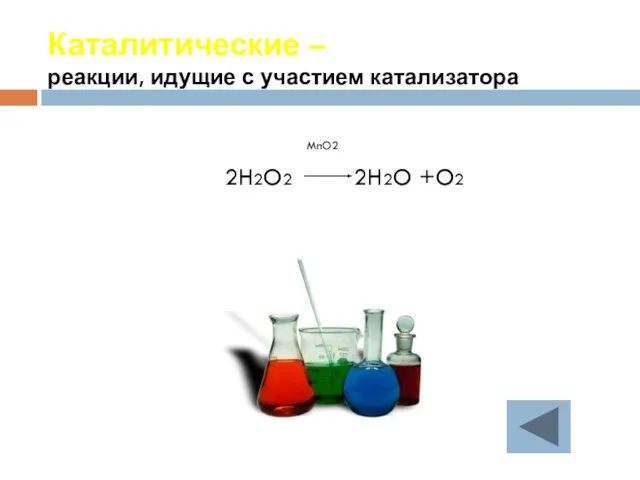
- 26. Каталитические – реакции, идущие с участием катализатора MnO2 2H2O2 2H2O +O2
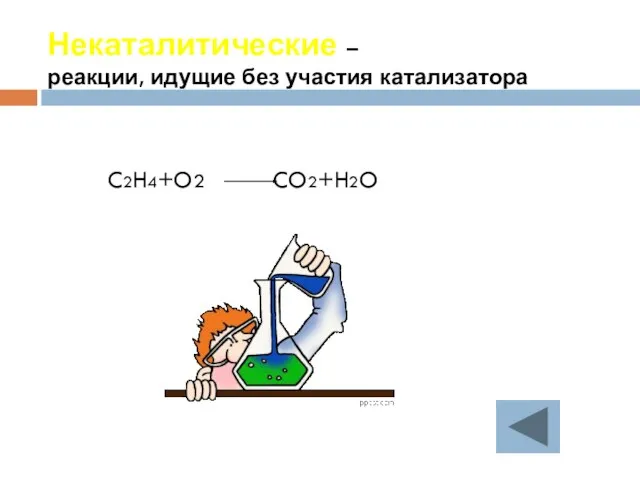
- 27. Некаталитические – реакции, идущие без участия катализатора C2H4+O2 CO2+H2O
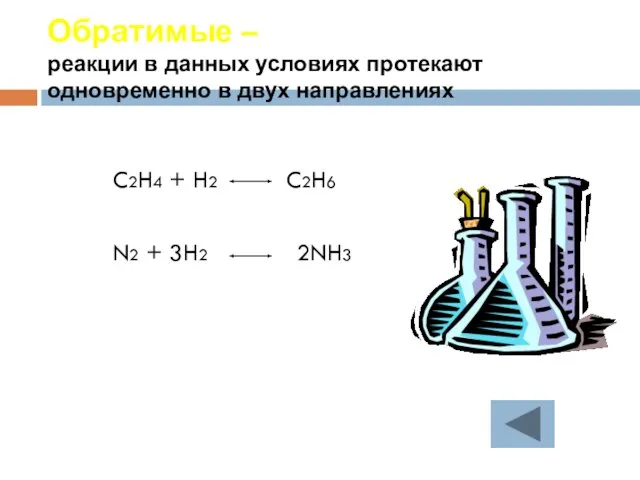
- 28. Обратимые – реакции в данных условиях протекают одновременно в двух направлениях C2H4 + H2 C2H6 N2
- 29. Необратимые – реакции в данных условиях протекают только в одном направлении H2SO4+BaCl2 BaSO4 + 2HCl 2Na+2H2O
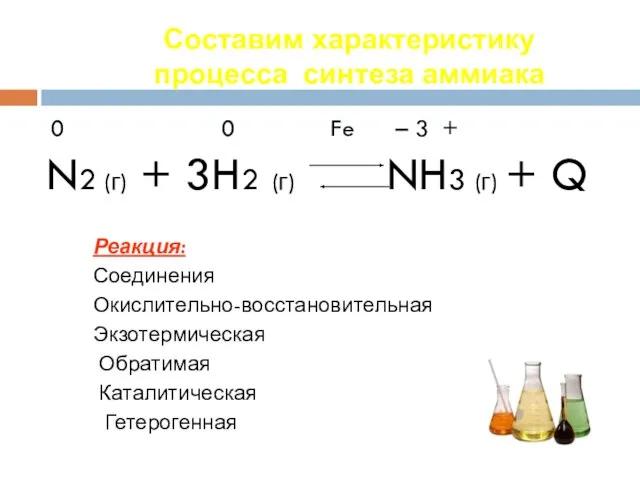
- 30. Составим характеристику процесса синтеза аммиака 0 0 Fe – 3 + N2 (г) + 3H2 (г)
- 31. Вывод: Классификация химических реакций условна. Ученые договорились разделить реакции на определенные типы по выделенным признакам Большинство
- 32. Выполнить задание Определить к какому типу принадлежат следующие реакции(соединения, разложения, замещения или обмена):
- 34. Скачать презентацию






















 Строение, свойства, биологическая роль дезоксисахаров и аминосахаров
Строение, свойства, биологическая роль дезоксисахаров и аминосахаров Кремний и его соединения
Кремний и его соединения Основания. 8 класс
Основания. 8 класс Диссоциация. Уравнения диссоциации
Диссоциация. Уравнения диссоциации Предмет биоорганической химии. Лекция 1
Предмет биоорганической химии. Лекция 1 Презентация по Химии "Здоровьесберегающие технологии при изучении химии"
Презентация по Химии "Здоровьесберегающие технологии при изучении химии"  Типы изомерии
Типы изомерии Презентация на тему Факторы, влияющие на скорость химической реакции
Презентация на тему Факторы, влияющие на скорость химической реакции  Основания. Классификация
Основания. Классификация Сероводород. Сульфиды
Сероводород. Сульфиды Алкины. Понятие об алкинах
Алкины. Понятие об алкинах Коррозия металлов, сплавов
Коррозия металлов, сплавов Производство полимеров в РК
Производство полимеров в РК Основания. Щелочи – растворимые основания
Основания. Щелочи – растворимые основания Классификация неорганических веществ
Классификация неорганических веществ Химический состав клетки
Химический состав клетки Химия в быту
Химия в быту Кислоты в химии
Кислоты в химии 9_OSNOVY_KOLANALIZA (1)
9_OSNOVY_KOLANALIZA (1) Химик белемнәрне тормышта куллану
Химик белемнәрне тормышта куллану Презентация на тему Глюкоза (10 класс)
Презентация на тему Глюкоза (10 класс)  Галогеноводородные кислоты
Галогеноводородные кислоты Оксиды. 8 класс
Оксиды. 8 класс Очистка рабочих электродов
Очистка рабочих электродов Техника безопасности на уроках химии
Техника безопасности на уроках химии Спирты. Понятие о спиртах
Спирты. Понятие о спиртах Презентация на тему Сахароза
Презентация на тему Сахароза  Практическая работа: наблюдение роста кристалов
Практическая работа: наблюдение роста кристалов