Содержание
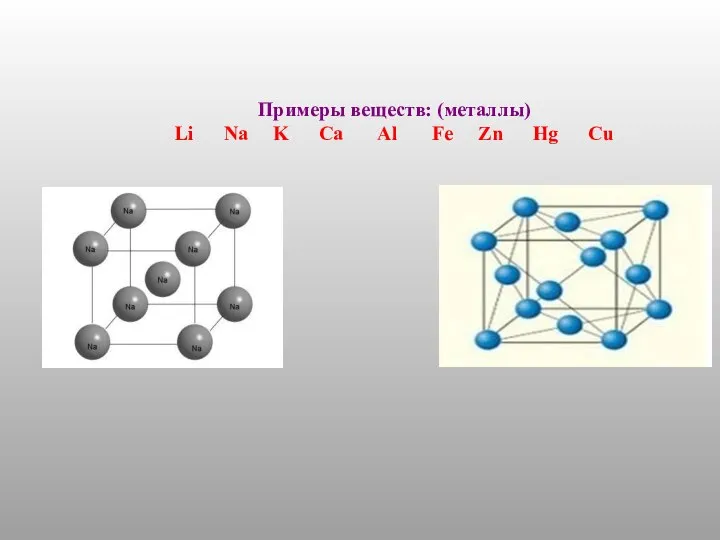
- 2. Типы химической связи ( по природе образования): Металлическая -обобществление электронов внешнего слоя между всеми ионами в
- 3. Примеры веществ: (металлы) Li Na K Ca Al Fe Zn Hg Cu
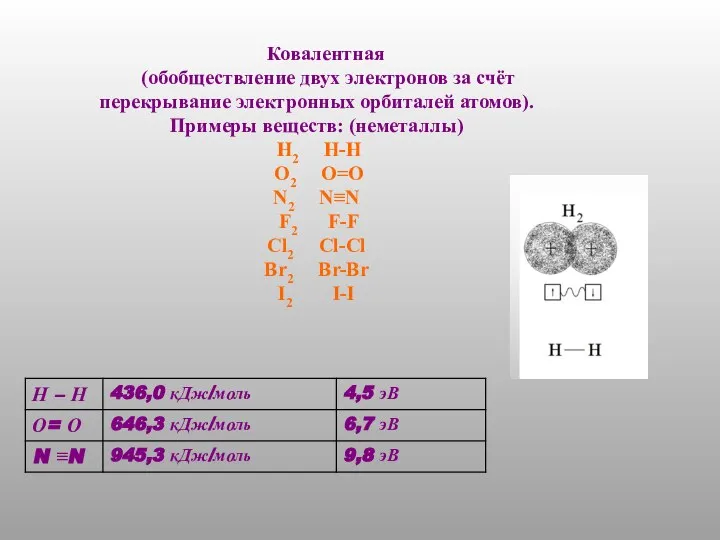
- 4. Ковалентная (обобществление двух электронов за счёт перекрывание электронных орбиталей атомов). Примеры веществ: (неметаллы) H2 H-H O2
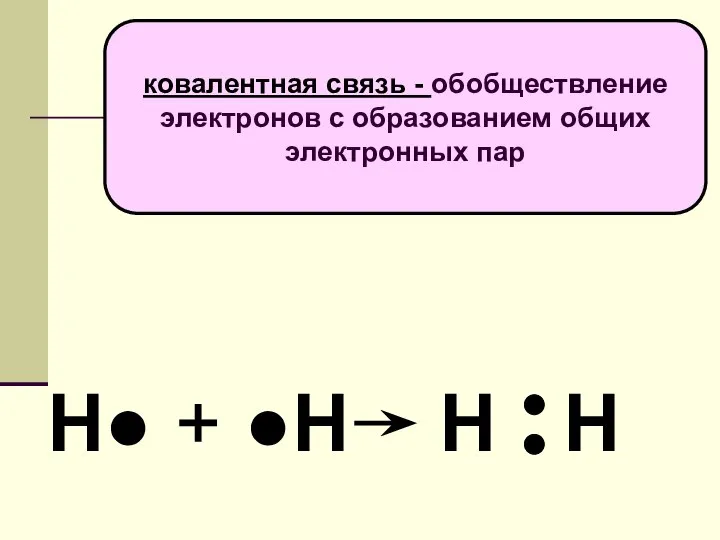
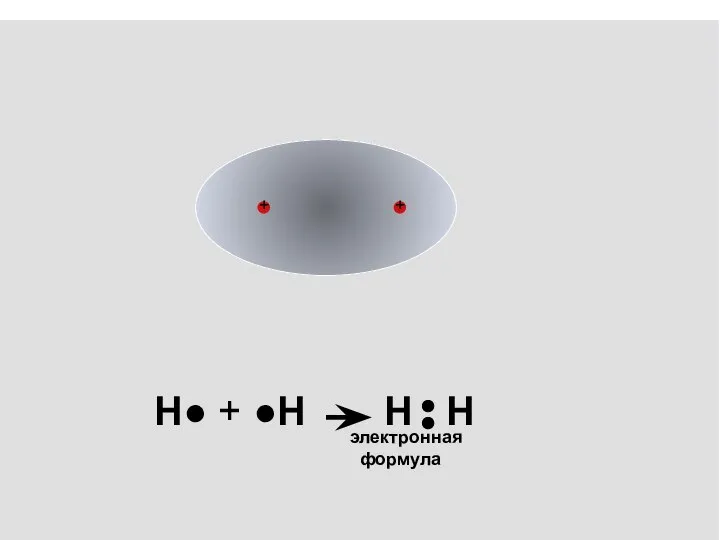
- 5. Н● + ●Н Н Н ковалентная связь - обобществление электронов с образованием общих электронных пар
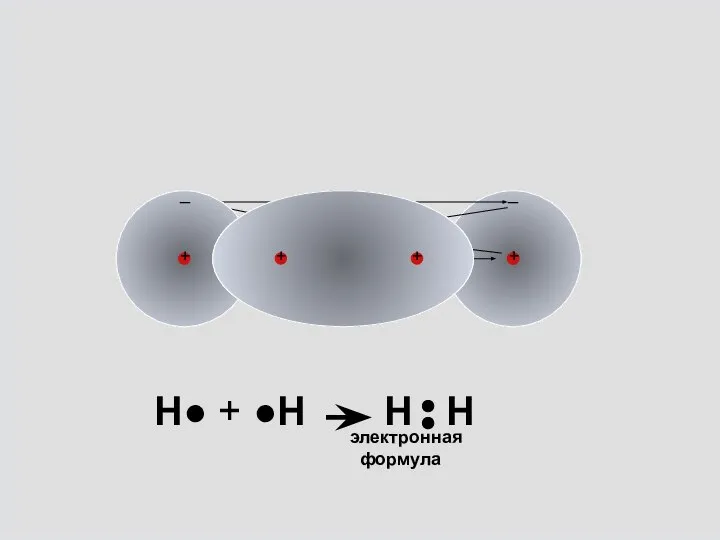
- 6. _ _ электронная формула Н● + ●Н Н Н
- 7. электронная формула Н● + ●Н Н Н
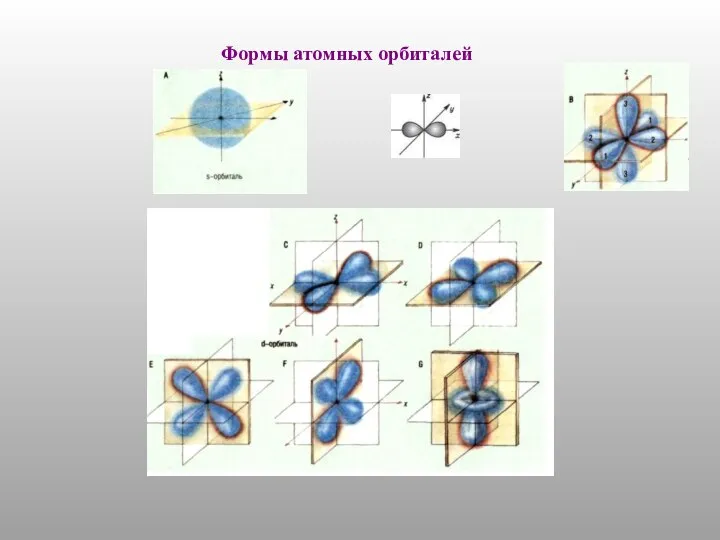
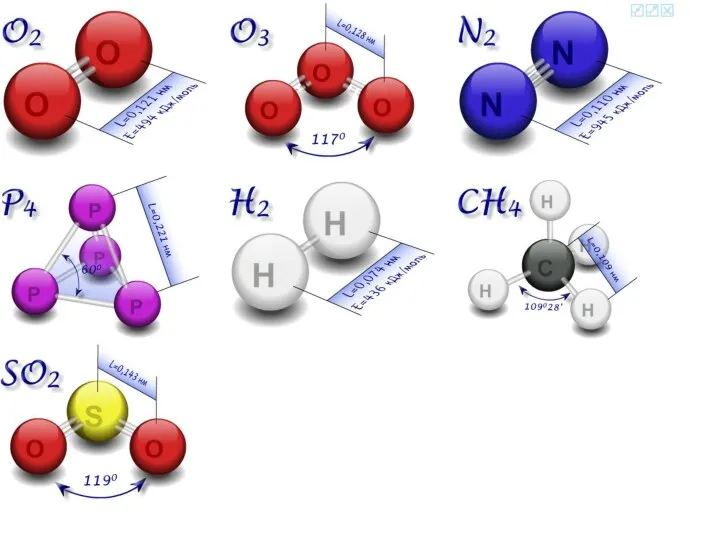
- 8. Формы атомных орбиталей
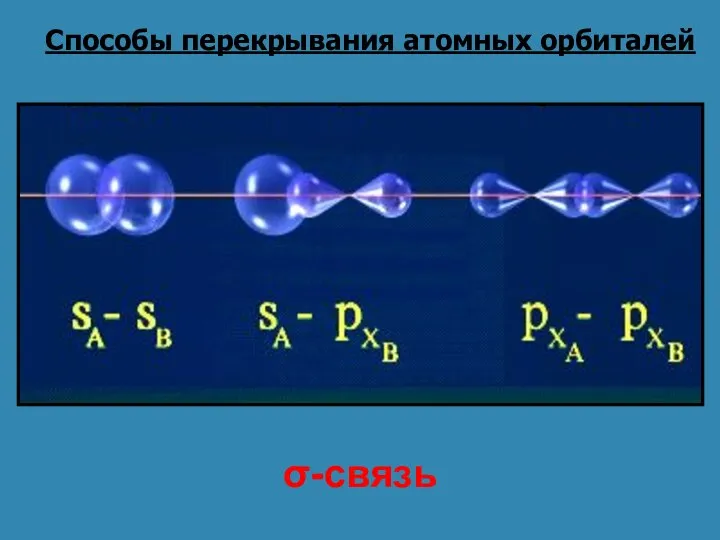
- 9. Способы перекрывания атомных орбиталей σ-связь
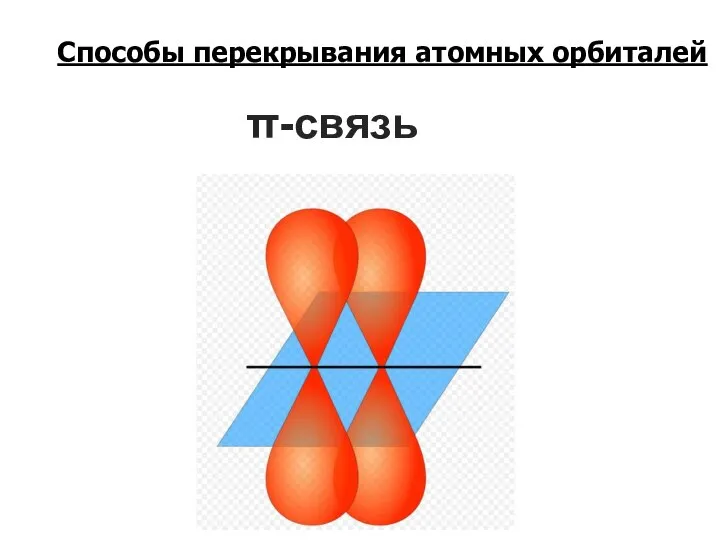
- 10. π-связь Способы перекрывания атомных орбиталей
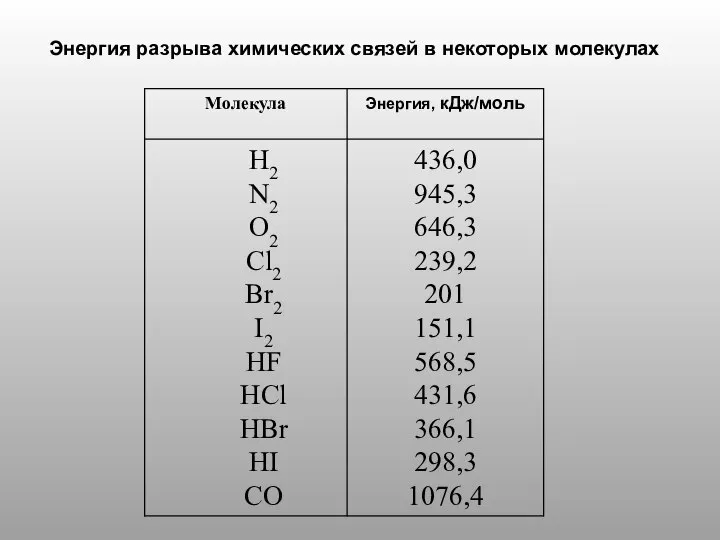
- 11. Энергия разрыва химических связей в некоторых молекулах
- 12. ТИПЫ СВЯЗИ В СЛОЖНЫХ ВЕЩЕСТВАХ МЕТАЛЛ-НЕМЕТАЛЛ НЕМЕТАЛЛ-НЕМЕТАЛЛ ИОННАЯ КОВАЛЕНТНАЯ ПОЛЯРНАЯ K2O NaCl HCl SO2 КОВАЛЕНТНАЯ ПОЛЯРНАЯ
- 13. Ионная (электростатическое притяжение противоположно заряженных ионов). металл + неметалл + большая разница в электроотрицательности (см. Справочник,
- 14. Молекулы хлороводорода Ионная кристаллическая решётка
- 17. Скачать презентацию




 Исследовательская работа по химии на тему: Интегративные проблемные ситуации
Исследовательская работа по химии на тему: Интегративные проблемные ситуации Водород. Свойства, применение
Водород. Свойства, применение Готовимся к ЕГЭ по органической химии Ароматические углеводороды
Готовимся к ЕГЭ по органической химии Ароматические углеводороды Магматические горные породы
Магматические горные породы Спирт – это жизненная необходимость или страшное зло…
Спирт – это жизненная необходимость или страшное зло… Классификация неорганических веществ
Классификация неорганических веществ Кремний и его соединения
Кремний и его соединения Исследовательская работа на тему: «Выращивание кристалла в домашних условиях» Работу выполнила ученица 10-а класса Алексеева О
Исследовательская работа на тему: «Выращивание кристалла в домашних условиях» Работу выполнила ученица 10-а класса Алексеева О Аминокислоты
Аминокислоты Физико - химические основы получения лекарственных препаратов (лекция 4)
Физико - химические основы получения лекарственных препаратов (лекция 4) Основные понятия и законы химии
Основные понятия и законы химии Подгруппа углерода
Подгруппа углерода Альдегиды и кетоны (часть 2)
Альдегиды и кетоны (часть 2) 7 Классиф неорг веществ презентация 2 (1)
7 Классиф неорг веществ презентация 2 (1) Сложные эфиры. Содержание. Определение
Сложные эфиры. Содержание. Определение Планетарная модель атома и его строение
Планетарная модель атома и его строение Презентация на тему Изотопы
Презентация на тему Изотопы  Химический анализ
Химический анализ Изготовление индикаторной бумаги
Изготовление индикаторной бумаги Алканы – строение, химические свойства
Алканы – строение, химические свойства Кислород и озон
Кислород и озон Структура периодической таблицы элементов
Структура периодической таблицы элементов Алканы
Алканы Фараонова Змея
Фараонова Змея Альдегиды. Кетоны
Альдегиды. Кетоны Каталітичні процеси нафтопереробки
Каталітичні процеси нафтопереробки Химия спирты одноатомные предельные
Химия спирты одноатомные предельные 897386 (2)
897386 (2)