Содержание
- 2. ПЛАН ЛЕКЦІЇ Комплексні сполуки (КС). Комплексоутворювач. Ліганди. Дентатність. Стійкість КС. Класифікація КС. Номенклатура КС. Просторова будова
- 3. КОМПЛЕКСНІ СПОЛУКИ CoCl3+(1-6)NH3→ CoCl3∙6NH3 відмінність від кристалогідратів (CuSO4∙5H2O) та подвійних солей (CaCl∙BaCl2) У Н2О не дисоціюють
- 4. КОМПЛЕКСНІ ІОНИ ⃰ не змінюються в кристалічному стані ⃰ у водному розчині CoCl3∙6NH3 неможливо аналітичними реакціями
- 5. КОМПЛЕКСНІ СПОЛУКИ За Вернером Кожна сполука містить комплексний іон, який складається з центрального атому - комплексоутворювача,
- 6. БУДОВА КОМПЛЕКСНИХ СПОЛУК комплексний іон, внутрішня сфера K3[Fe(CN)6] Комплексні сполуки − містять хоча б один ковалентний
- 7. КОМПЛЕКСОУТВОРЮВАЧІ Лужні, лужноземельні метали і їх катіони утворюють нестійкі комплекси; У комплексоутворювача повинні бути в наявності
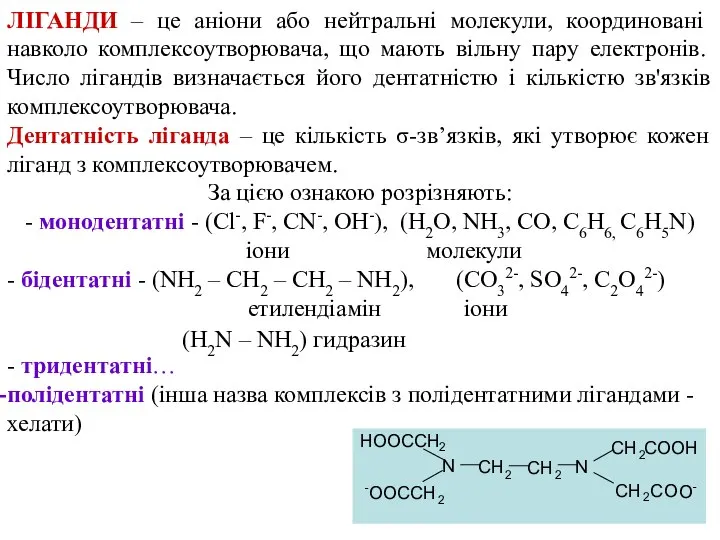
- 8. ЛІГАНДИ – це аніони або нейтральні молекули, координовані навколо комплексоутворювача, що мають вільну пару електронів. Число
- 9. СТІЙКІСТЬ КОМПЛЕКСНИХ СПОЛУК Первинна дисоціація. При розчиненні комплексних сполук (іонний зв'язок) процес руйнування кристалічної решітки протікає
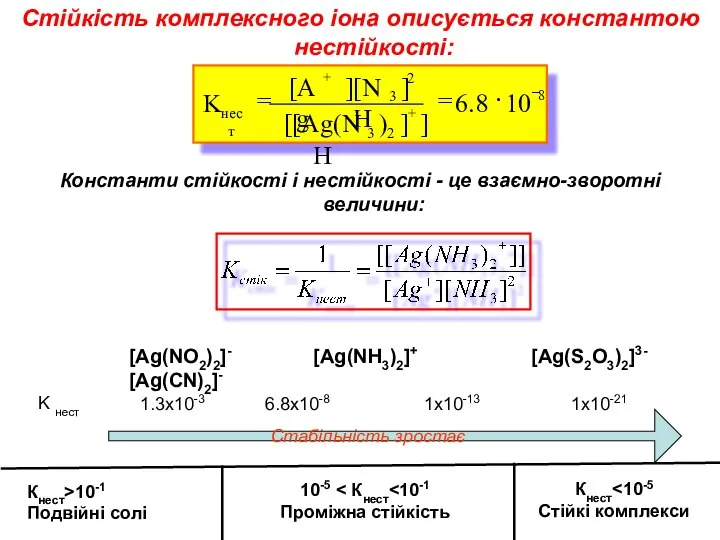
- 10. Стійкість комплексного іона описується константою нестійкості: Константи стійкості і нестійкості - це взаємно-зворотні величини: [Ag(NO2)2]- [Ag(NH3)2]+
- 11. Ступінь окиснення комплексоутворювача Щоб визначити ступінь окиснення комплексоутворювача, треба від заряду комплексного іона відняти сумарний заряд
- 12. 1. За зарядом комплексного іона КОМПЛЕКС Катіонний [Co(NH3)6]3+, [Ni(NH3)6]2+ Аніонний [Ag(CN)2]-, [Fe(CN)6]4- Нейтральний (неелектроліти, не дисоціюють
- 13. КЛАСИФІКАЦІЯ КОМПЛЕКСНИХ СПОЛУК 3. За природою лігандів ● Аквакомплекси [Co(H2O)6]Cl3 ● Аміакати и амінати [Ag(NH3)2]OH CH3NH2,
- 14. НОМЕНКЛАТУРА КОМПЛЕКСНИХ СПОЛУК (IUPAC) КС називають справа наліво, тобто першим аніон, потім катіон. У назві комплексного
- 15. НОМЕНКЛАТУРА КОМПЛЕКСНИХ СПОЛУК (IUPAC) 4. У катіонних комплексах - спочатку у називному відмінку називають аніон, потім
- 16. ХІМІЧНИЙ ЗВ'ЯЗОК У КОМПЛЕКСНИХ СПОЛУКАХ Метод валентних зв'язків (комплексоутворювач (акцептор) і ліганди (донори) пов'язані двуелектроним ковалентним
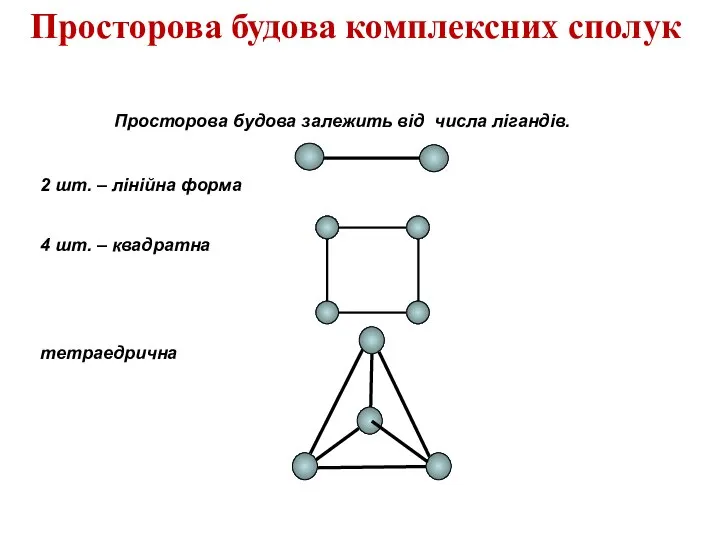
- 17. Просторова будова комплексних сполук Просторова будова залежить від числа лігандів. 2 шт. – лінійна форма 4
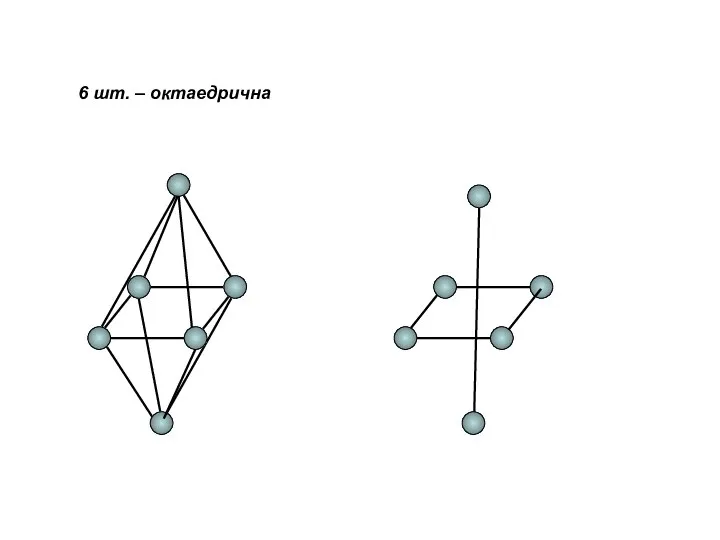
- 18. 6 шт. – октаедрична
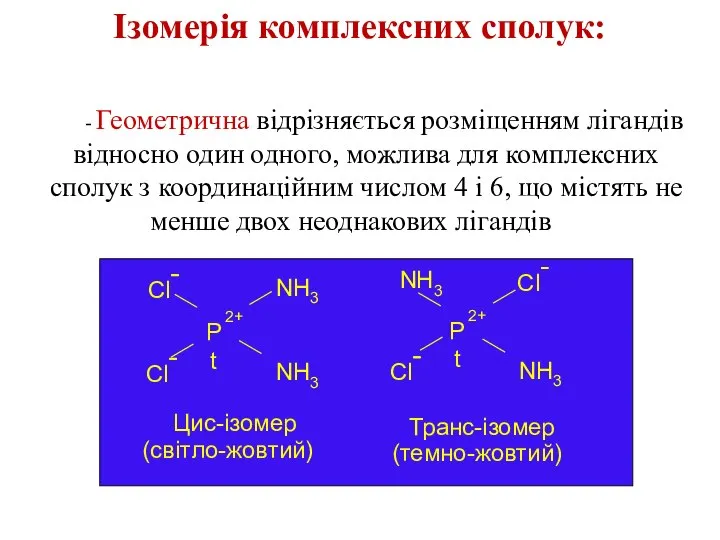
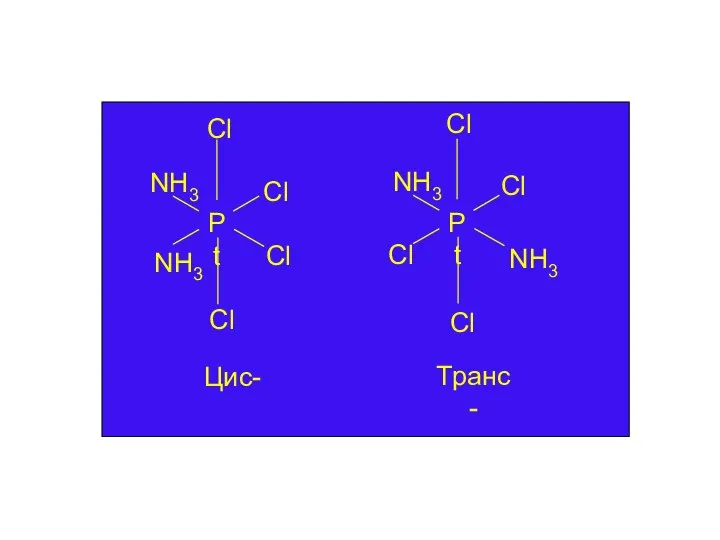
- 19. Ізомерія комплексних сполук: - Геометрична відрізняється розміщенням лігандів відносно один одного, можлива для комплексних сполук з
- 21. оптична (дзеркальна) (Вернер А., 1911 р.) можлива для асиметричних комплексів, які не мають жодної площині симетрії,
- 22. координаційна ізомерія можлива для сполук, що складаються з комплексних катіонів та комплексних аніонів, кожен з яких
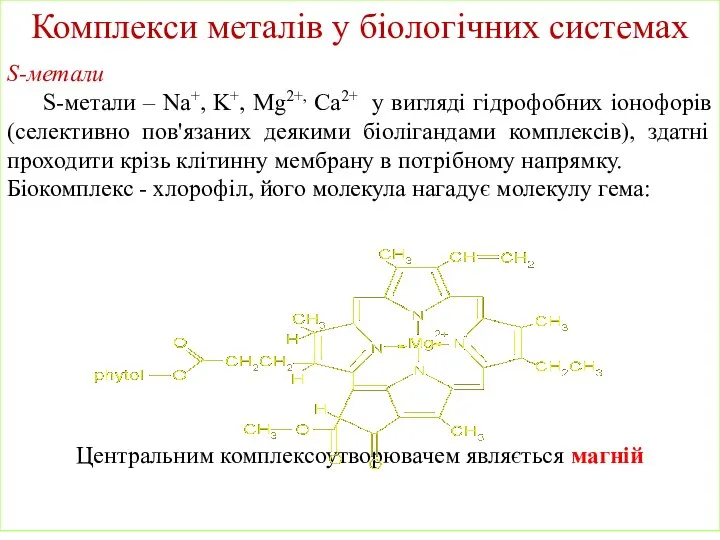
- 23. Комплекси металів у біологічних системах S-метали S-метали – Na+, K+, Mg2+, Ca2+ у вигляді гідрофобних іонофорів
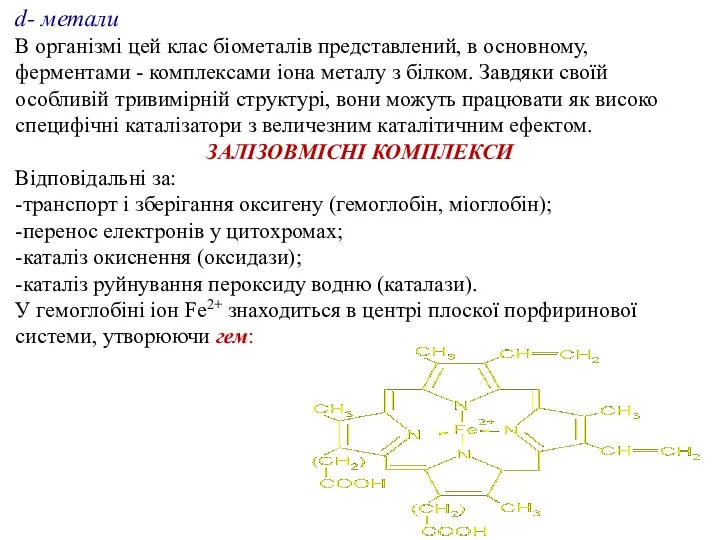
- 24. d- метали В організмі цей клас біометалів представлений, в основному, ферментами - комплексами іона металу з
- 25. СРС!!! Цитохроми - широко розповсюджена група внутрішньоклітинних окисно-відновних каталізаторів. Принцип дії їх полягає в перенесенні електронів
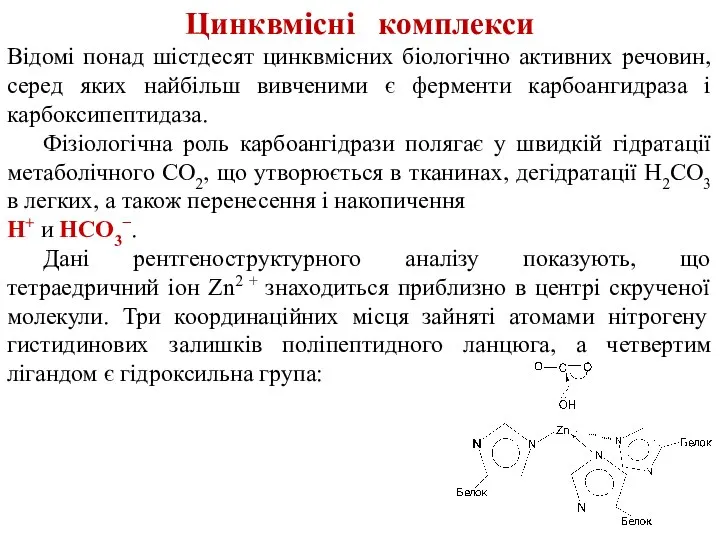
- 26. Цинквмісні комплекси Відомі понад шістдесят цинквмісних біологічно активних речовин, серед яких найбільш вивченими є ферменти карбоангидраза
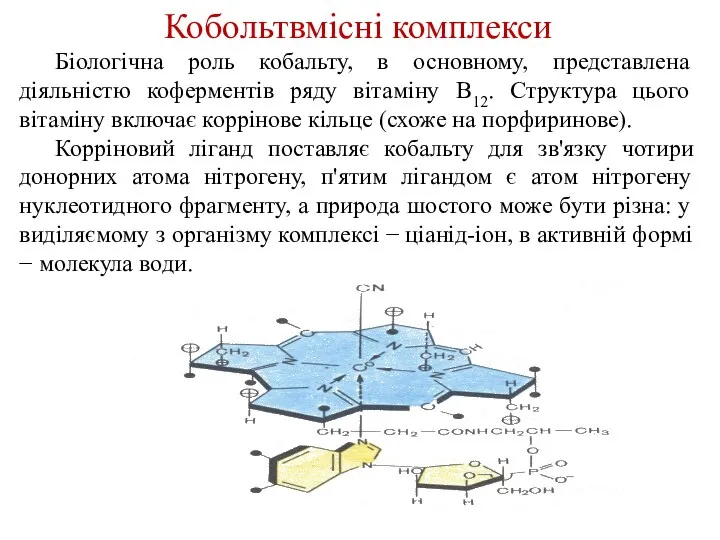
- 27. Кобольтвмісні комплекси Біологічна роль кобальту, в основному, представлена діяльністю коферментів ряду вітаміну В12. Структура цього вітаміну
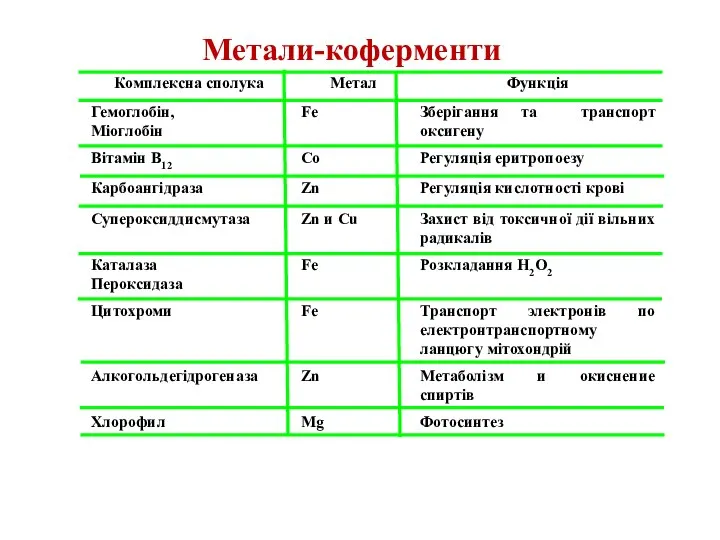
- 28. Метали-коферменти
- 30. Скачать презентацию




![БУДОВА КОМПЛЕКСНИХ СПОЛУК комплексний іон, внутрішня сфера K3[Fe(CN)6] Комплексні сполуки − містять](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1076405/slide-5.jpg)



![1. За зарядом комплексного іона КОМПЛЕКС Катіонний [Co(NH3)6]3+, [Ni(NH3)6]2+ Аніонний [Ag(CN)2]-, [Fe(CN)6]4-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1076405/slide-11.jpg)
![КЛАСИФІКАЦІЯ КОМПЛЕКСНИХ СПОЛУК 3. За природою лігандів ● Аквакомплекси [Co(H2O)6]Cl3 ● Аміакати](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1076405/slide-12.jpg)






 Plexiglas. Органическое стекло
Plexiglas. Органическое стекло Без золота прожить можно, без соли нельзя
Без золота прожить можно, без соли нельзя Основы химической кинетики
Основы химической кинетики Флэшмоб: Лаборатория на кухне
Флэшмоб: Лаборатория на кухне Алкены. Роль алкенов в жизни человека
Алкены. Роль алкенов в жизни человека Водородные соединения неметаллов
Водородные соединения неметаллов Химиялық қоспалар
Химиялық қоспалар Терпеноиды. Эфирные масла
Терпеноиды. Эфирные масла Нітрогеновмісні сполуки
Нітрогеновмісні сполуки Основные законы и понятия химии. Основные классы неорганических соединений. Химический эквивалент. Закон эквивалентов
Основные законы и понятия химии. Основные классы неорганических соединений. Химический эквивалент. Закон эквивалентов Арены. Электронное строение молекулы бензола. Гомологический ряд аренов, номенклатура, изомерия
Арены. Электронное строение молекулы бензола. Гомологический ряд аренов, номенклатура, изомерия Оксиды азота
Оксиды азота Гибридизация
Гибридизация Презентация на тему Классификация углеводов
Презентация на тему Классификация углеводов  Ионные двигатели
Ионные двигатели План выполнения домашней работы по теме Алкадиены
План выполнения домашней работы по теме Алкадиены Презентация на тему Полимеры
Презентация на тему Полимеры  Азот. Аммиак. Соли аммония (1)
Азот. Аммиак. Соли аммония (1) Изучение микроклимата коровника с целью создания системы очистки воздуха от аммиака
Изучение микроклимата коровника с целью создания системы очистки воздуха от аммиака Алканы: строение, номенклатура, изомерия, физические свойства
Алканы: строение, номенклатура, изомерия, физические свойства Соединения алифатического ряда
Соединения алифатического ряда Нуклеинови киселини
Нуклеинови киселини Применение личностно-ориентированного подхода в обучении химии
Применение личностно-ориентированного подхода в обучении химии 20141013_dragotsennye_kamni_yuzhnogo_urala
20141013_dragotsennye_kamni_yuzhnogo_urala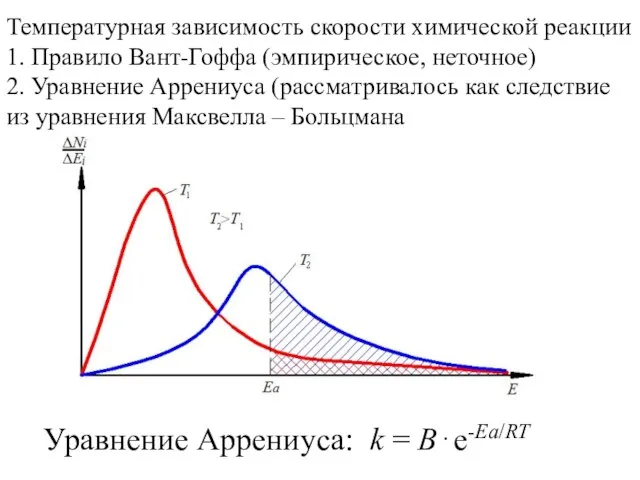 Температурная зависимость скорости химической реакции
Температурная зависимость скорости химической реакции Выращивание кристаллов медного купороса с использованием воды различной степени очистки
Выращивание кристаллов медного купороса с использованием воды различной степени очистки Коррозия металлов
Коррозия металлов Комплексонометрическое титрование. 5 лекция. Часть 2
Комплексонометрическое титрование. 5 лекция. Часть 2