Содержание
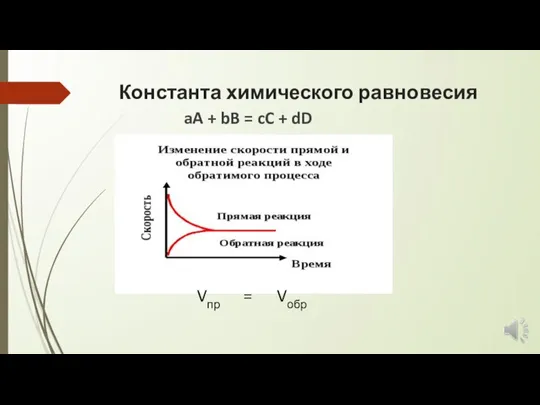
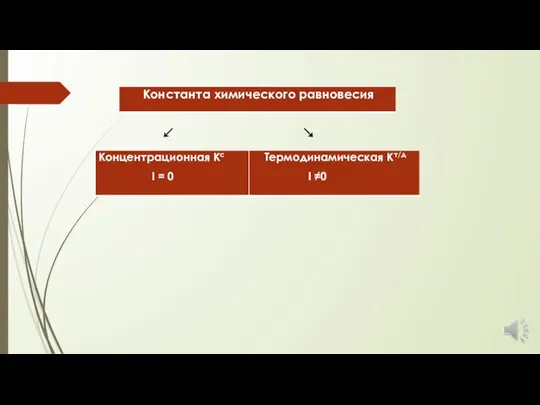
- 2. Константа химического равновесия aA + bB = cC + dD Vпр = Vобр
- 3. С кинетической точки зрения химическое равновесие – состояние динамического равновесия реакций в растворе, при котором каждый
- 5. Закон действующих масс справедлив для идеальных растворов электролитов. С увеличением концентрации компонентов химической реакции наблюдаются отклонения
- 8. ↙ ↘
- 9. Равновесие в растворах комплексных соединений
- 11. Часто для описания равновесий реакций комплексообразования используют условные константы устойчивости. Такие константы применяют в тех случаях,
- 12. ↙ ↓ ↘
- 13. Равновесие в гетерогенных системах Гетерогенные системы – это системы, состоящие из двух или более фаз, разделенных
- 16. Условие образования осадков
- 18. Скачать презентацию













 Хлордың қолданылуы
Хлордың қолданылуы Структура и свойства чистого титана
Структура и свойства чистого титана Портландцемент гидравликалық байланыстырғыш
Портландцемент гидравликалық байланыстырғыш Лакмусовые бумажки из сока краснокочанной капусты
Лакмусовые бумажки из сока краснокочанной капусты Нуклеиновые кислоты
Нуклеиновые кислоты Электролиз. Правила электролиза
Электролиз. Правила электролиза Изучение процесса замерзания воды
Изучение процесса замерзания воды Ogļūdeņražu karboksilatvasinājumi
Ogļūdeņražu karboksilatvasinājumi Теория строения вещества. Межмолекулярные взаимодействия. Водородная связь. Специфические взаимодействия
Теория строения вещества. Межмолекулярные взаимодействия. Водородная связь. Специфические взаимодействия Презентация на тему Строение Бензола
Презентация на тему Строение Бензола  Хлор. Химические свойства и применение. Лекция 5
Хлор. Химические свойства и применение. Лекция 5 Коррозия металлов и борьба с ней. Лабораторная работа
Коррозия металлов и борьба с ней. Лабораторная работа Электрокинетические явления. Электрофорез. Макро- и микроэлектрофорез. Лекция 9
Электрокинетические явления. Электрофорез. Макро- и микроэлектрофорез. Лекция 9 Что такое кислота? Составляем общую формулу
Что такое кислота? Составляем общую формулу Вода. Классы неорганических соединений. 8 класс
Вода. Классы неорганических соединений. 8 класс Трёхкомпонентные системы. Закон распределения. Экстракция. Свойства разбавленных растворов неэлектролитов
Трёхкомпонентные системы. Закон распределения. Экстракция. Свойства разбавленных растворов неэлектролитов Атом- сложная частица
Атом- сложная частица Строение атома
Строение атома Органическая химия
Органическая химия Окислительно - восстановительные реакции
Окислительно - восстановительные реакции Презентация на тему Применение электролиза
Презентация на тему Применение электролиза  Фосфор, строение, свойства
Фосфор, строение, свойства Предельные одноосновные карбоновые кислоты. Сложные эфиры
Предельные одноосновные карбоновые кислоты. Сложные эфиры Презентация на тему Химия и сельское хозяйство Пестициды
Презентация на тему Химия и сельское хозяйство Пестициды  Тела и вещества. Химический диктант
Тела и вещества. Химический диктант Презентация на тему Ионные уравнения
Презентация на тему Ионные уравнения  Альфа- и бета- распад. Правило смещения
Альфа- и бета- распад. Правило смещения Вода. Классы неорганических соединений. 8 класс
Вода. Классы неорганических соединений. 8 класс