Слайд 2Кислород
Химический знак – О
Относительная атомная масса Ar(O) = 16
Химическая формула простого вещества
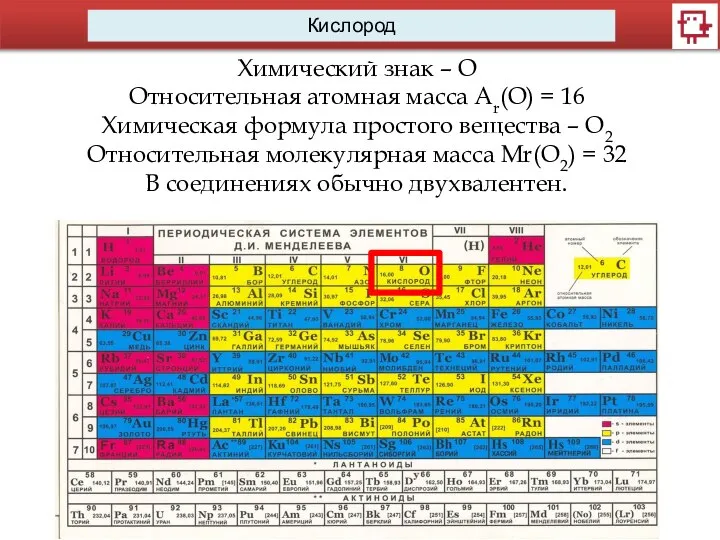
– О2
Относительная молекулярная масса Mr(O2) = 32
В соединениях обычно двухвалентен.
Слайд 4Кислород
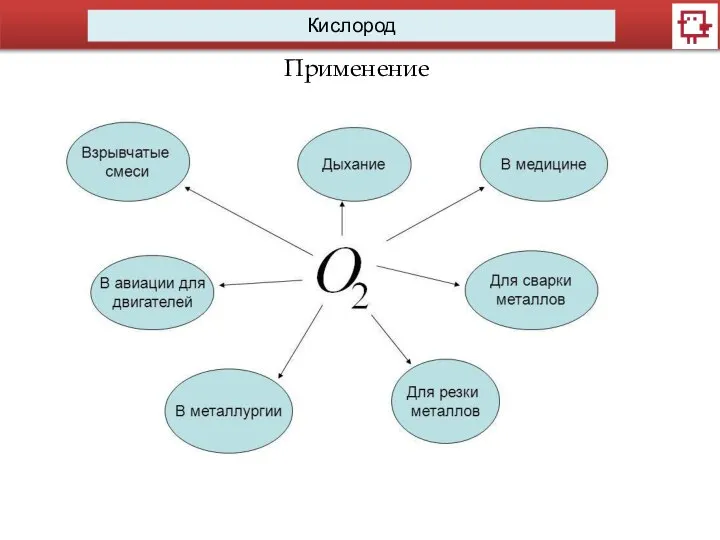
Применение. Взрывчатые смеси.
Оксивилит — получается при пропитке древесного угля жидким кислородом.

Слайд 5Кислород
Применение. Дыхание.
При дыхании происходит сжигание углеводородного вещества и выделение энергии.
Вам наиболее
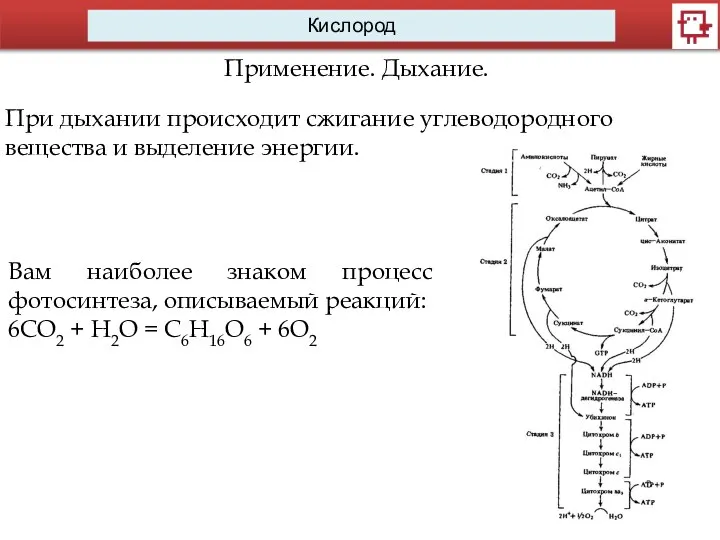
знаком процесс фотосинтеза, описываемый реакций:
6СО2 + Н2О = С6Н16О6 + 6О2
Слайд 6Кислород
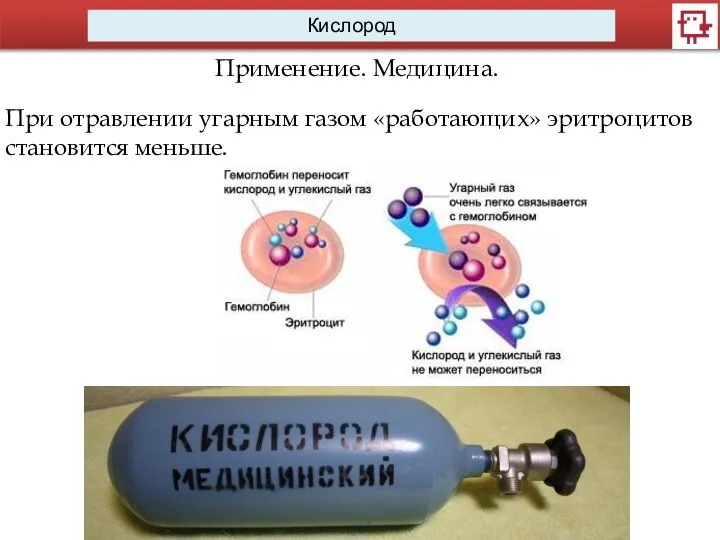
Применение. Медицина.
При отравлении угарным газом «работающих» эритроцитов становится меньше.
Слайд 7Кислород
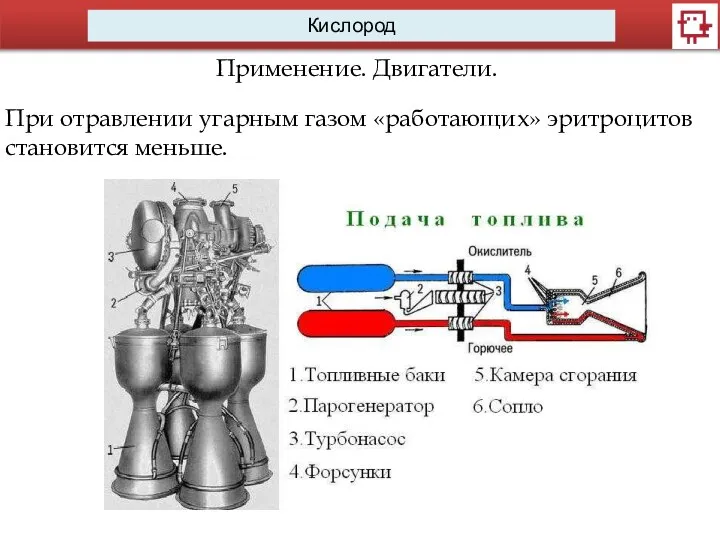
Применение. Двигатели.
При отравлении угарным газом «работающих» эритроцитов становится меньше.
Слайд 8Кислород
Применение. Сварка.
При сжигании смеси ацетилена (С2Н2) или водорода (Н2) с кислородом в

специальных горелках температура пламени достигает 3000С
Слайд 9Кислород
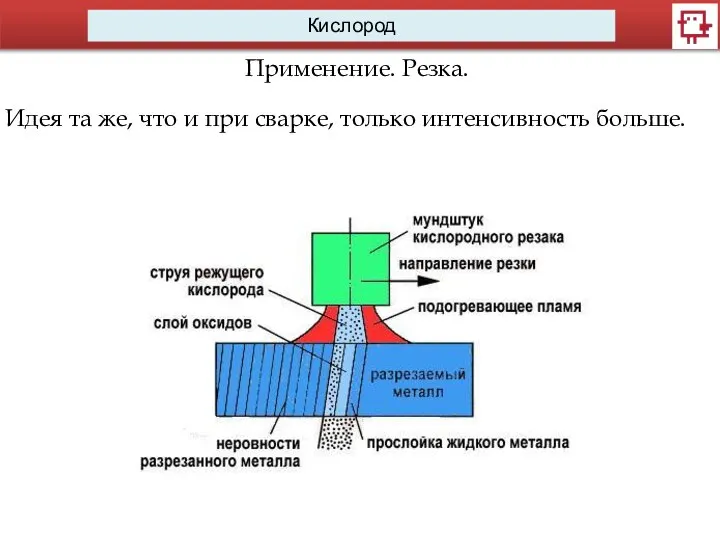
Применение. Резка.
Идея та же, что и при сварке, только интенсивность больше.
Слайд 10Кислород
Применение. Металлургия.
Например, производство стали. Для этого нужно удалить избытки С, что и
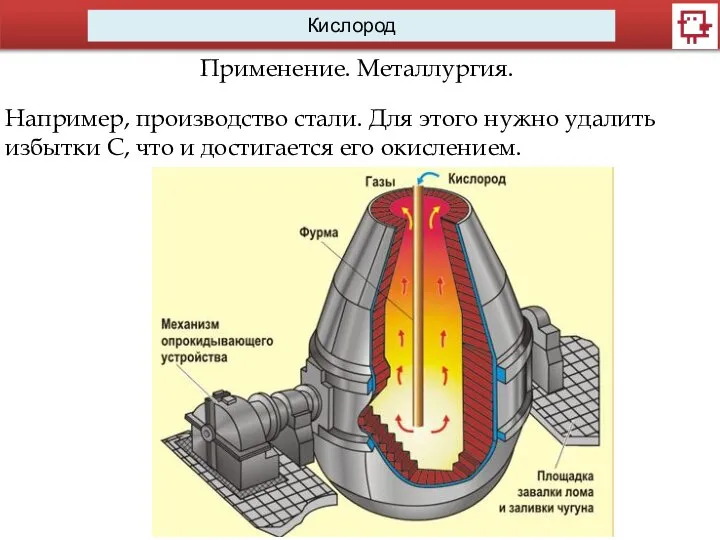
достигается его окислением.
Слайд 11Задачки
Вычислите содержание элементов в масс. % в:
А) оксиде серы (IV)
В)В перманганате KMnO4










 Органическая химия. Классификация. Номенклатура
Органическая химия. Классификация. Номенклатура Номенклатура органических соединений. Упражнения
Номенклатура органических соединений. Упражнения Ковалентная полярная связь
Ковалентная полярная связь Алюминий и сплавы алюминия
Алюминий и сплавы алюминия Физический этап развития периодического закона
Физический этап развития периодического закона a319f492a6071afff03d7efc722c906b
a319f492a6071afff03d7efc722c906b Первоначальные химические понятия
Первоначальные химические понятия Диеновые углеводороды. Алкадиены
Диеновые углеводороды. Алкадиены Алканы
Алканы Медь и ее сплавы
Медь и ее сплавы Классификация силикатов
Классификация силикатов День химии
День химии Аминокислоты. Пептиды. Белки. Тема 2
Аминокислоты. Пептиды. Белки. Тема 2 Металлы - наши друзья или враги
Металлы - наши друзья или враги Решение расчетных задач
Решение расчетных задач Теория электролитической диссоциации
Теория электролитической диссоциации Силумины. Виды силуминов
Силумины. Виды силуминов Пористые стекла
Пористые стекла Масс-спектрометрия шерсти волка обыкновенного Canis lupus
Масс-спектрометрия шерсти волка обыкновенного Canis lupus Звездный час по химии
Звездный час по химии Ионная полимеризация
Ионная полимеризация Повторение по теме Химические реакции
Повторение по теме Химические реакции Химия - неотъемлемая часть жизни
Химия - неотъемлемая часть жизни Мастер - класс: Окислительно-восстановительные реакции
Мастер - класс: Окислительно-восстановительные реакции Взаимодействие карбонатов с разбавленными кислотами. Качественные реакции на карбонаты
Взаимодействие карбонатов с разбавленными кислотами. Качественные реакции на карбонаты Получение и реакции пиразина
Получение и реакции пиразина Алюминий. Из истории открытия
Алюминий. Из истории открытия Бораны и карбораны
Бораны и карбораны