Содержание
- 4. до целых
- 8. электронно-графическая формула строения атома
- 11. !!! Исключение в случае хрома мы наблюдаем проскок: один электрон s-подуровня переходит на d-подуровень для того,
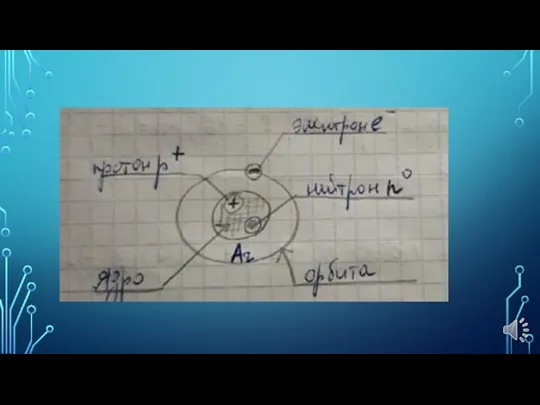
- 12. ИЗОТОПЫ ЭЛЕМЕНТОВ Изотопы – это нуклиды с одинаковым зарядом ядра, но разным!!! массовым числом и числом
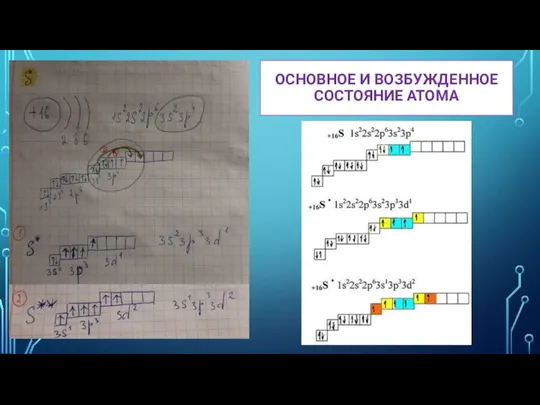
- 13. ОСНОВНОЕ И ВОЗБУЖДЕННОЕ СОСТОЯНИЕ АТОМА
- 14. ВАРИАНТ 1
- 15. ВАРИАНТ 1 ОТВЕТЫ
- 17. Скачать презентацию











 Вещество как система. Основы классификации и номенклатуры неорганических веществ
Вещество как система. Основы классификации и номенклатуры неорганических веществ Презентация на тему Микроэлементы: Хром, Йод, Фтор
Презентация на тему Микроэлементы: Хром, Йод, Фтор  Скорость химических реакций
Скорость химических реакций Липиды
Липиды Алкены (часть 2)
Алкены (часть 2) Основания, их состав и название
Основания, их состав и название Презентация на тему Природный и попутный нефтяной газы, их состав, использование
Презентация на тему Природный и попутный нефтяной газы, их состав, использование  Свойства Н2
Свойства Н2 Электроны в кристаллах. Приложения зонной теории
Электроны в кристаллах. Приложения зонной теории Разбор контрольной работы. Химия (9 класс)
Разбор контрольной работы. Химия (9 класс) Пересчет данных анализа, выраженных в ионной форме
Пересчет данных анализа, выраженных в ионной форме Кабинет химии
Кабинет химии Типичные реакции оснований
Типичные реакции оснований Спирты в жизни человека
Спирты в жизни человека Строение бензола
Строение бензола Обновление экзаменационных моделей ОГЭ и ЕГЭ по химии
Обновление экзаменационных моделей ОГЭ и ЕГЭ по химии Внеклассное мероприятие по химии Первоначальные химические понятия
Внеклассное мероприятие по химии Первоначальные химические понятия Теоретические основы каталитических процессов переработки нефтегазового сырья. Тема 6
Теоретические основы каталитических процессов переработки нефтегазового сырья. Тема 6 Аргентум, или серебро
Аргентум, или серебро Химические свойства карбоновых кислот
Химические свойства карбоновых кислот Алкины. Понятие об алкинах
Алкины. Понятие об алкинах Влияние эллементов на состав растений. Содержание тяжелого металла в растениях. Нитраты в растениях
Влияние эллементов на состав растений. Содержание тяжелого металла в растениях. Нитраты в растениях Металлы
Металлы Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях
Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях Иттрий-алюминиевый гранат и иттрий-алюминиевый перовскит
Иттрий-алюминиевый гранат и иттрий-алюминиевый перовскит Презентация на тему Вода – растворитель
Презентация на тему Вода – растворитель  Медь и ее сплавы
Медь и ее сплавы Методика изготовления сенсора
Методика изготовления сенсора