Содержание
- 2. Содержание презентации 1. История получения аммиака. Строение атома азота. 3. Образование молекулы. 4. Строение молекулы аммиака.
- 3. Аммиак также может быть обязан своим названием оазису бога Аммона в Северной Африке, находящемуся на перекрестке
- 4. По некоторым другим сведениям, аммиак мог получить современное название от древнеегипетского слова «амониан». Так называли всех
- 5. Сокращенное название «аммиак» которым мы всегда пользуемся, ввел в обиход в 1801 году русский ученый-химик, академик
- 6. История открытия аммиака Аммиак был получен в чистом виде в 1774 г. английским химиком Джозефом Луи
- 7. 1723-1802 г. В 1784 французский химик Бертолле разложением аммиака доказал его элементный состав, который в 1787
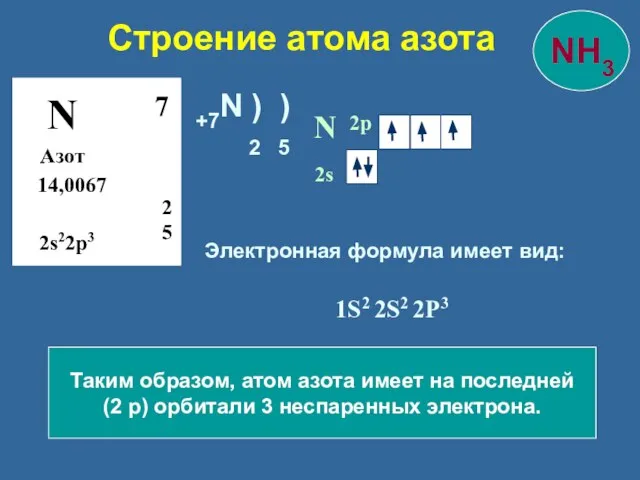
- 8. Строение атома азота N Азот 14,0067 2 5 7 2s22p3 N 2s 2p Таким образом, атом
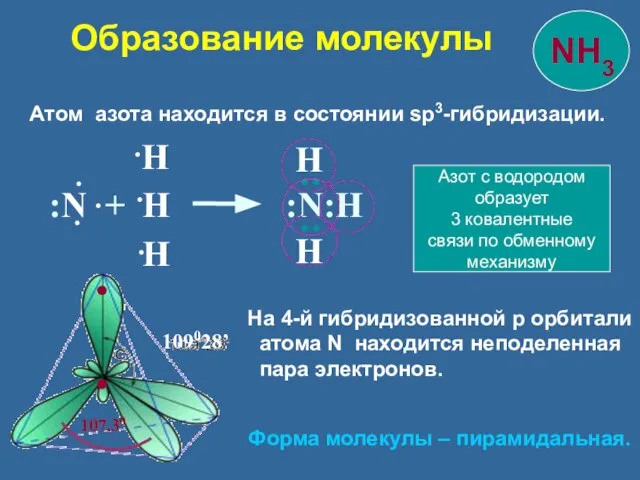
- 9. Атом азота находится в состоянии sp3-гибридизации. 109028’ :N + H :N:Н Н Н Н : :
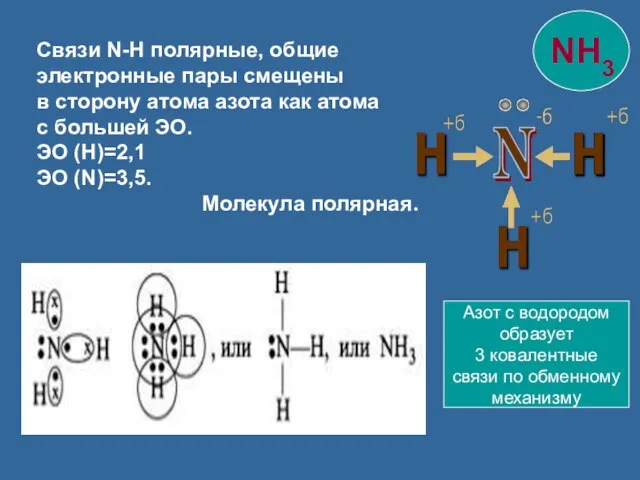
- 10. Связи N-H полярные, общие электронные пары смещены в сторону атома азота как атома с большей ЭО.
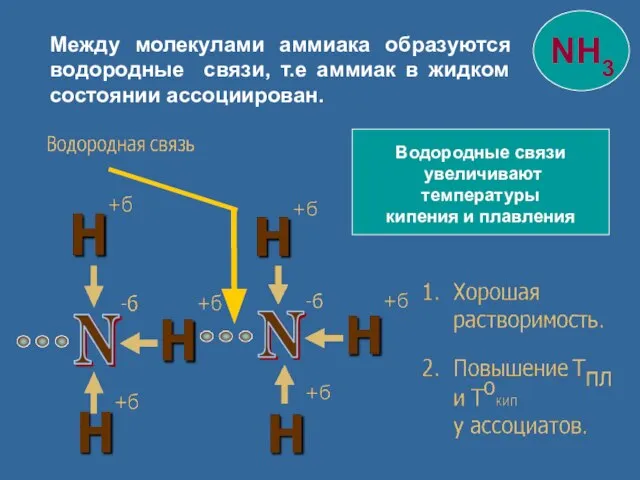
- 11. Водородные связи увеличивают температуры кипения и плавления Между молекулами аммиака образуются водородные связи, т.е аммиак в
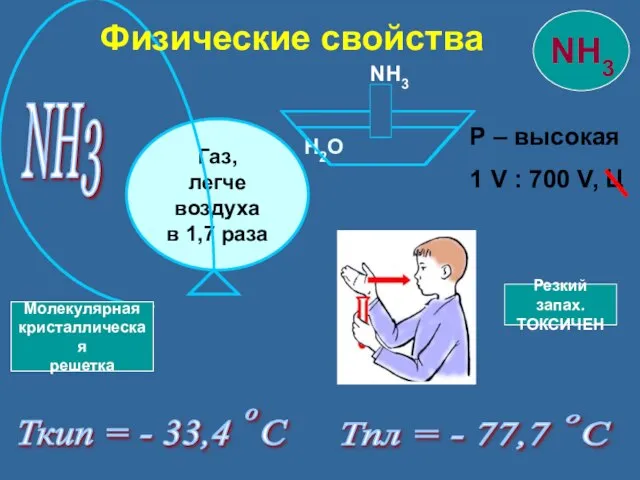
- 12. NH3 Р – высокая 1 V : 700 V, Ц Ткип = - 33,4 С Тпл
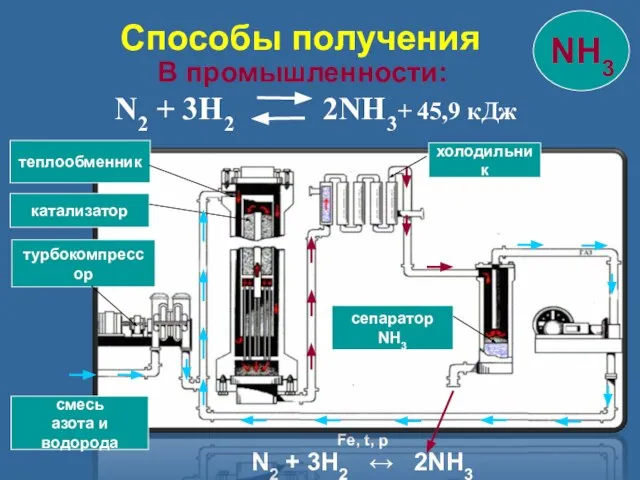
- 13. В промышленности: N2 + 3H2 2NH3+ 45,9 кДж смесь азота и водорода турбокомпрессор катализатор теплообменник холодильник
- 14. В лаборатории: 1. Действием щелочей на соли аммония: 2. Гидролиз нитридов:
- 15. NH3 – низшая степень окисления азота. -3 Аммиак – восстановитель 2. Основные свойства (неподеленная пара электронов)
- 16. Реакция горения аммиака (до N2): 4NH3 + 3O2 = 2N2+ 6H2O = Аммиак-восстановитель
- 17. Каталитическое окисление аммиака (до NO): 4NH3 + 5O2 = 4NO + 6H2O Аммиак-восстановитель
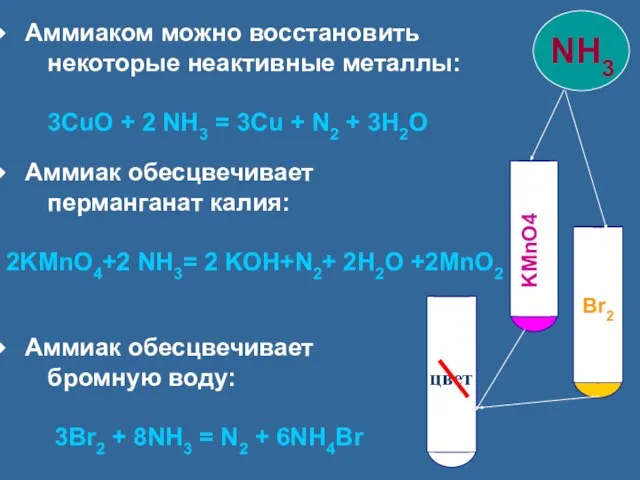
- 18. Аммиаком можно восстановить некоторые неактивные металлы: 3CuO + 2 NH3 = 3Cu + N2 + 3H2O
- 19. Аммиак реагирует с водой, образуя гидрат аммиака (аммиачная вода): NH3 + H2O =NH4OH Изменяет окраску индикаторов:
- 20. NH3 + HCl → NH4Cl хлорид аммония (нашатырь) 2 NH3 + H2SO4 → (NH4)2 SO4 сульфат
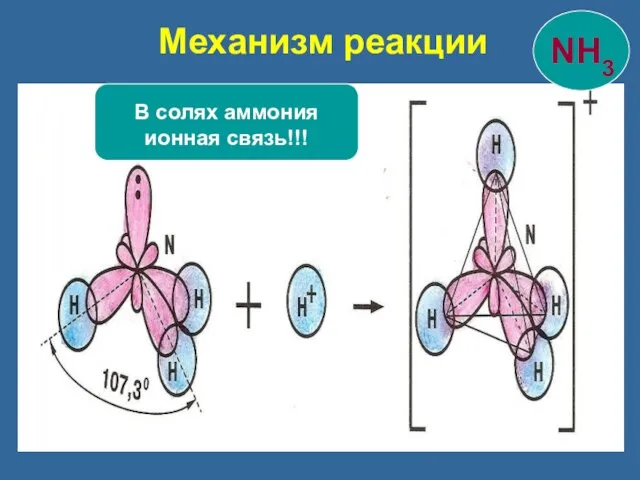
- 21. Механизм реакции В солях аммония ионная связь!!!
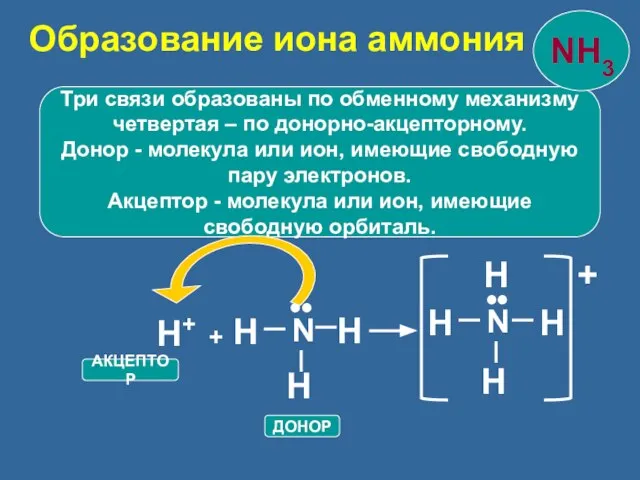
- 22. Три связи образованы по обменному механизму четвертая – по донорно-акцепторному. Донор - молекула или ион, имеющие
- 23. Специфические свойства 1. Взаимодействие с гипохлоритом натрия (образование гидразина): 2NH3 + NaClO = N2H4 + NaCl+H2O
- 24. Специфические свойства 2. Взаимодействие с активными металлами (образование амидов): 2NH3 + 2К = 2KNH2 + Н2
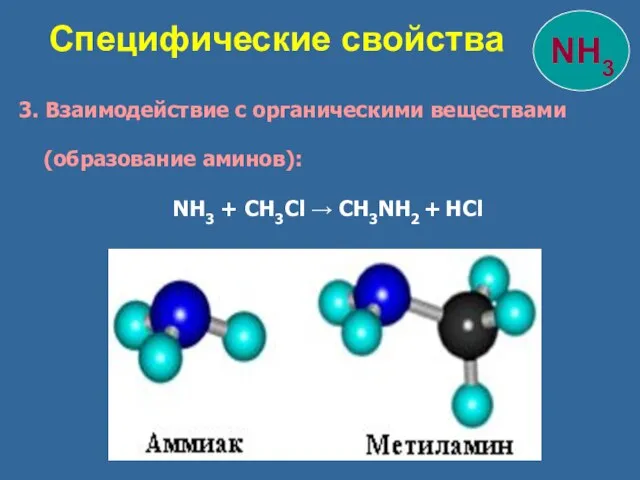
- 25. 3. Взаимодействие с органическими веществами (образование аминов): NH3 + CH3Cl → CH3NH2 + HCl Специфические свойства
- 26. 4. Комплексообразование: CuSO4 + 4NH3 → [Cu(NH3)4]SO4 Cu(OH)2+ 4NH3 → [Cu(NH3)4](OH)2 Специфические свойства Благодаря своим электронодонорным
- 27. Обобщение
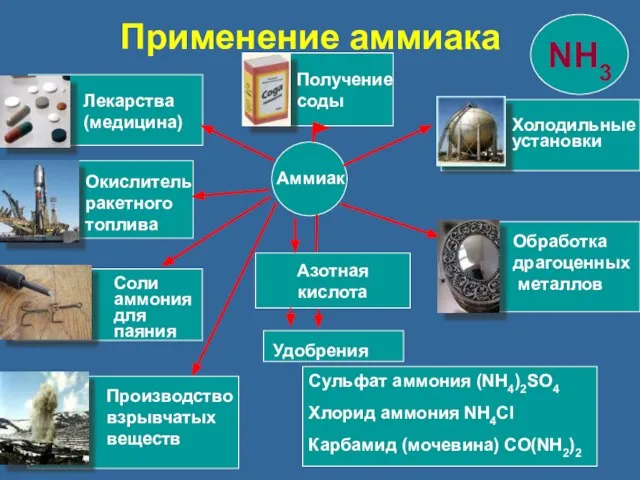
- 28. Азотная кислота Сульфат аммония (NH4)2SO4 Хлорид аммония NH4Cl Карбамид (мочевина) CO(NH2)2 Аммиак Удобрения Лекарства (медицина) Окислитель
- 29. Техногенные катастрофы
- 30. 1. Нельзя прикасаться к разлитому веществу, это может вызвать болезненный ожог кожных покровов. 2. При отравлении
- 31. Правильно! Ошибка Ошибка Ошибка 1 кислот солей оксидов оснований 2 Ошибка Правильно! Ошибка Ошибка щелочами кислотами
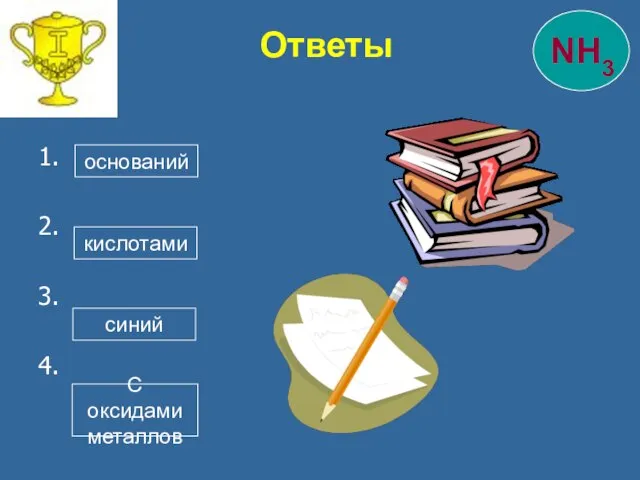
- 32. 1. 2. 3. 4. Ответы оснований кислотами синий С оксидами металлов
- 33. Осуществите цепочку превращений: N2?NH3?(NH4)2SO4?NH4Cl?NH3 ?N2 ? Li3N ? NH3 Готовимся к экзамену Запишите уравнения реакций. Где
- 34. Решите задачи: Уровень А: Какой объем аммиака можно получить при нагревании 7,4 г. гидроксида кальция с
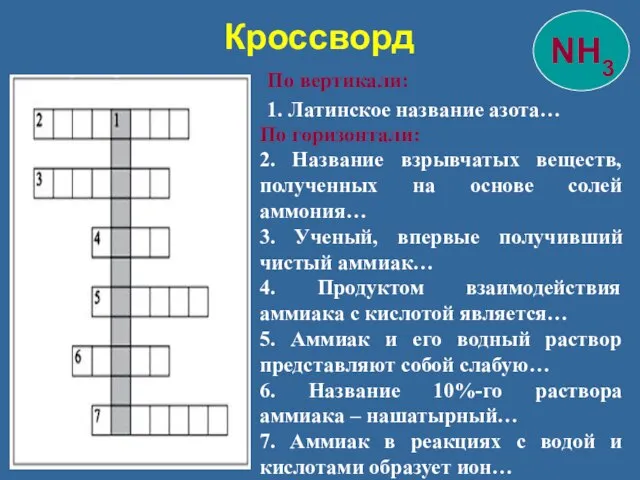
- 35. Кроссворд По вертикали: 1. Латинское название азота… По горизонтали: 2. Название взрывчатых веществ, полученных на основе
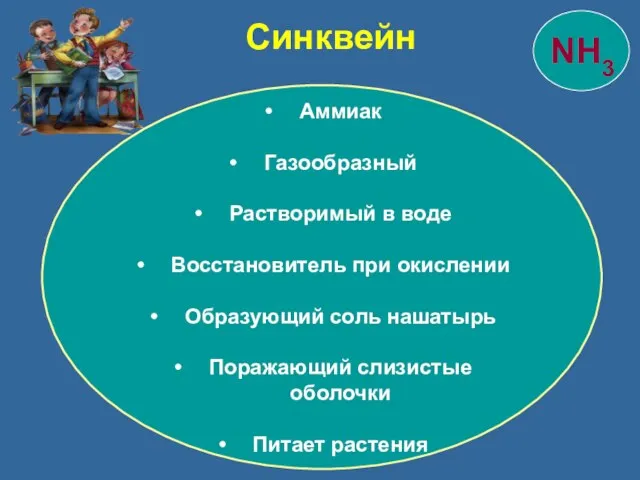
- 36. Синквейн Аммиак Газообразный Растворимый в воде Восстановитель при окислении Образующий соль нашатырь Поражающий слизистые оболочки Питает
- 38. Скачать презентацию














![4. Комплексообразование: CuSO4 + 4NH3 → [Cu(NH3)4]SO4 Cu(OH)2+ 4NH3 → [Cu(NH3)4](OH)2 Специфические](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/909540/slide-25.jpg)






 Строение вещества
Строение вещества Udens ipasibas
Udens ipasibas Презентация на тему Каучук
Презентация на тему Каучук  Фосфор
Фосфор Плотность веществ. Задачи
Плотность веществ. Задачи Соли
Соли Презентация на тему Задачи на смеси и сплавы (9 класс)
Презентация на тему Задачи на смеси и сплавы (9 класс)  Презентация на тему Химический алфавит
Презентация на тему Химический алфавит  Аминокилоты. Получение и применение
Аминокилоты. Получение и применение Химическая кибернетика
Химическая кибернетика Презентация на тему Показатели воды - её жесткость и кислотность
Презентация на тему Показатели воды - её жесткость и кислотность  Что изучает химия?
Что изучает химия? Номенклатура алканов разветвлённого строения
Номенклатура алканов разветвлённого строения Практическая работа: Очистка загрязнённой поваренной соли
Практическая работа: Очистка загрязнённой поваренной соли Взаимное притяжение и отталкивание молекул
Взаимное притяжение и отталкивание молекул Соли. Химические свойства
Соли. Химические свойства Карбоновые кислоты
Карбоновые кислоты Чистые вещества и смеси
Чистые вещества и смеси Презентация
Презентация Голубое золото
Голубое золото Лекарственные растения содержащие флавоноиды
Лекарственные растения содержащие флавоноиды Общая характеристика МЕТАЛЛОВ
Общая характеристика МЕТАЛЛОВ Перекрывающиеся гены
Перекрывающиеся гены Химические реакции
Химические реакции Общие свойства неметаллов
Общие свойства неметаллов Соли: получение
Соли: получение Порядковый номер элемента. Изотопы
Порядковый номер элемента. Изотопы L4_Aminoacids, peptides, proteins (2)
L4_Aminoacids, peptides, proteins (2)