Слайд 2 Что такое аллотропия ?
Аллотро́пия (от др.-греч. ἄλλος «другой» + τρόπος «поворот, свойство») — существование двух и более простых веществ одного

и того же химического элемента.
Явление аллотропии обусловлено либо различным состоянием молекул простого вещества (аллотропия состава), либо способом размещения атомов или молекул в кристаллической решётке (аллотропия формы).
Слайд 3 История
Понятие аллотропии введено в науку Й. Берцелиусом в 1841 году для обозначения разных

форм существования элементов; одновременно он предполагал, по-видимому, применить его и к изомерии соединений. После принятия гипотезы А. Авогадро в 1860 году стало понятно, что элементы могут существовать в виде многоатомных молекул, например, О2 — кислород и О3 — озон.
В начале XX века было признано, что различия в кристаллической структуре простых веществ (например, углерода или фосфора) также являются причиной аллотропии. В 1912
году В. Оствальд отметил, что аллотропия элементов является просто частным случаем полиморфизма кристаллов, и предложил отказаться от этого термина. Однако по настоящее время эти термины используются параллельно. Аллотропия относится только к простым веществам, независимо от их агрегатного состояния; полиморфизм — только к твёрдому состоянию независимо от того, простое это вещество или сложное. Таким образом, эти термины совпадают для простых твёрдых веществ (кристаллическая сера, фосфор, железо и др.)[1].
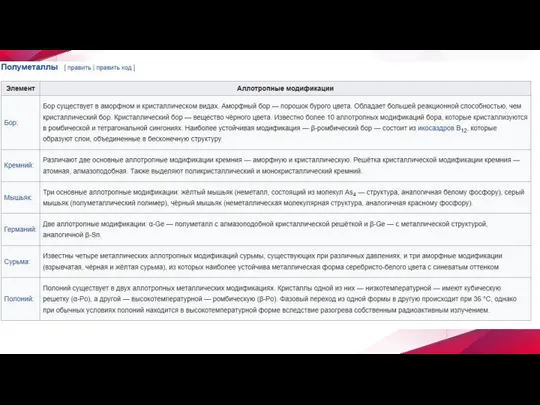
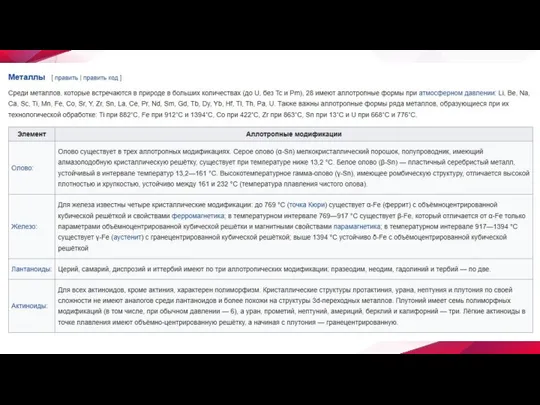
Слайд 5 Примеры аллотропии
В настоящее время известно более 400 разновидностей простых веществ. Способность элемента

к образованию аллотропных форм обусловлена строением атома, которое определяет тип химической связи, строение молекул и кристаллов.
Как правило, большее число аллотропных форм образуют элементы, имеющие переменные значения координационного числа или степени окисления (олово, фосфор). Другим важным фактором является катенация — способность атомов элемента образовывать гомоцепные структуры (например, сера). Склонность к аллотропии более выражена у неметаллов, за исключением галогенов, благородных газов, и полуметаллов.
Принято обозначать различные аллотропические формы одного и того же элемента строчными буквами греческого алфавита; причём форму, существующую при самых низких температурах, обозначают буквой α, следующую — β и т. д.
Слайд 10Энантиотропные и монотропные переходы
Переход одной аллотропной модификации в другую происходит при изменении

температуры или давления (или одновременном воздействии обоих факторов) и связан со скачкообразным изменением свойств вещества. Этот процесс бывает обратимым (энантиотропным) и необратимым (монотропным).
Примером энантиотропного перехода может служить превращение ромбической серы в моноклинную α-S (ромб.) ↔ β-S (монокл.) при 95,6 °C. При обычной температуре стабильной является ромбическая модификация серы, которая при нагревании до 95,6 °С при нормальном давлении переходит в моноклинную форму. Последняя при охлаждении ниже 95,6 °С вновь переходит в ромбическую форму. Таким образом, переход одной формы серы в другую происходит при одной и той же температуре, и сами формы называются энантиотропными.
Слайд 12Энантиотропные и монотропные переходы
К монотропному переходу относится превращение белого фосфора P4 под давлением 1,25 ГПа

и температуре 200 °C в более стабильную модификацию — чёрный фосфор. При возвращении к обычным условиям обратный переход не происходит. Переход из нестабильной формы в стабильную в принципе возможен при любой температуре, а обратный — нет, то есть определенная точка перехода отсутствует. Ещё один пример — превращение графита в алмаз при давлении 6 ГПа и температуре 1500 °C в присутствии катализатора (никель, хром, железо и другие металлы), то есть при условиях термодинамической устойчивости алмаза. Тогда как алмаз легко и быстро переходит в графит при температурах выше 1000 °С. В обоих случаях давление способствует превращению, поскольку образуется вещества с более высокой плотностью, чем исходные.
Слайд 13 Модификации
Три известные модификации олова переходят друг в друга различным образом. При обычных условиях

устойчиво β-Sn (пластичное белое олово) с тетрагональной кристаллической решеткой[2]. Выше 173 °С β-Sn энантиотропно превращается в хрупкую модификацию γ-Sn, а ниже 13,2 °C β-Sn переходит монотропно в порошкообразное α-Sn (серое олово) с кубической решёткой типа алмаза. Этот полиморфный переход происходит с малой скоростью, но резко ускоряется в контакте с серым оловом — плотные куски белого олова рассыпаются в пыль («оловянная чума»). Обратный процесс возможен только путём переплавки.[3]
Слайд 14Факты аллотропии водорода О2
Орто- и пара-водород действительно имеют небольшое различие в физических

свойствах, но в природе всегда существуют в виде газовой смеси, а не отдельно; плюс к этому - химические их свойства тоже одинаковы. Водород может существовать в виде орто- и пара-водорода. В молекуле орто-водорода o-H2 (т. пл. −259,10 °C, т. кип. −252,56 °C) ядерные спины параллельны, а у пара-водорода p-H2 (т. пл. −259,32 °C, т. кип. −252,89 °C) — антипараллельны.
Слайд 15Характеристика аллотропных модификаций углерода
Задача 943. Охарактеризовать аллотропные модификации углерода и указать причину различия

их свойств.
Слайд 16
Решение: Известно несколько аллотропных модификаций углерода.














 Степень окисления. Составление формул бинарных соединений. 8 класс
Степень окисления. Составление формул бинарных соединений. 8 класс Химиялық есептердің кеңістіктік шешімдері
Химиялық есептердің кеңістіктік шешімдері Важнейшие классы неорганических соединений. Соли
Важнейшие классы неорганических соединений. Соли Классификация загрязняющих веществ по фазово-дисперсному составу
Классификация загрязняющих веществ по фазово-дисперсному составу Пример выполнения проверочной работы по теме углеводороды
Пример выполнения проверочной работы по теме углеводороды Физико-химические свойства нефтепродуктов
Физико-химические свойства нефтепродуктов Образование дипептида
Образование дипептида Химия и жизнь
Химия и жизнь Алканы. Физические свойствава алканов
Алканы. Физические свойствава алканов Сравнительная характеристика стиральных порошков
Сравнительная характеристика стиральных порошков Энергетические уровни
Энергетические уровни Морфологія та походження мінералів. Елементи кристалографії
Морфологія та походження мінералів. Елементи кристалографії Железо
Железо Белки
Белки Суд над химическим элементом Углерод
Суд над химическим элементом Углерод Приёмы работы с текстом на уроках химии
Приёмы работы с текстом на уроках химии Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях
Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях Открытия в химии
Открытия в химии Газ тәрізді өнімдер бромды сутек
Газ тәрізді өнімдер бромды сутек Электролиз
Электролиз Концентрированная серная кислота
Концентрированная серная кислота Презентация на тему Основные законы науки химии
Презентация на тему Основные законы науки химии  хімія
хімія Типичные ошибки, допускаемые учащимися при выполнении задания повышенного уровня сложности С-5 ЕГЭ по химии
Типичные ошибки, допускаемые учащимися при выполнении задания повышенного уровня сложности С-5 ЕГЭ по химии Алканы: состав, строение, изомерия, номенклатура, получение
Алканы: состав, строение, изомерия, номенклатура, получение Основные свойства и опасности нефти. Безопасность для танкеров
Основные свойства и опасности нефти. Безопасность для танкеров Жиры
Жиры Карбораны. Особенности строения молекулы. Получение и химические свойства
Карбораны. Особенности строения молекулы. Получение и химические свойства