Слайд 2Коагуляция
При коагуляции изменяются физико-химические свойства систем: появляется мутность, снижается осмотическое давление,

изменяются электрическая проводимость и характер вязкости. На изменении физико-химических свойств основаны методы наблюдения и изучения процесса коагуляции.
Слайд 3Коагуляция
Факторы вызывающие коагуляцию:
старение ДС;
изменение температуры (сильное нагревание или охлаждение вплоть до замораживания);
механическое

воздействие (интенсивное встряхивание, перемешивание, перекачивание по трубам);
действие света и различного рода излучений;
действие электрических разрядов;
действие электролитов (наиболее часто).
Слайд 4Коагуляция
Многочисленные исследования показали, что почти все электролиты, взятые в достаточном количестве,

способны коагулировать коллоидные растворы. Это связано с тем, что электролиты могут изменять структуру ДЭС, а следовательно уменьшать или увеличивать ζ-потенциал и поэтому увеличивать или уменьшать электростатическое отталкивание.
Слайд 5Коагуляция
По механизму воздействия электролита на ДЭС различают
нейтрализационную коагуляцию, которую вызывают неиндифферентные электролиты, а также

электролиты с многозарядными ионами (требуются небольшие количества электролита);
концентрационную, которую вызывают индифферентные электролиты с однозарядными ионами и требуют достаточно больших количеств электролита.
Слайд 6Коагуляция
Количественные характеристики коагуляции:
Минимальное количество электролита, которое необходимо добавить к 1 дм3 золя,

чтобы вызвать его коагуляцию, называется порогом коагуляции золя данным электролитом. (Ск, ммоль/дм3).
Величину, обратную порогу коагуляции, называют коагулирующей способностью и обозначают Vк (Vк = 1/Ск). Она выражает число объемов золя, скоагулированных 1 ммоль иона-коагулятора.
Слайд 7Коагуляция
Экспериментально порог коагуляции определяют добавлением растворов электролита разных концентраций с(х) к

серии одинаковых коллоидных растворов; после некоторой экспозиции устанавливают минимальную концентрацию иона, вызывающего коагуляцию.
Расчет проводят по формуле:
где V0 - объем золя, V1 -минимальный объем раствора электролита, вызвавший коагуляцию золя.
Слайд 8Коагуляция
Наиболее распространенные методы определения порога коагуляции состоят в наблюдениях за изменением

светорассеяния (через определенное время после смешивания золя с электролитом) или в титровании золя раствором электролита до начала явной коагуляции.
Слайд 9Коагуляция
При осуществлении коагуляции важны количества добавляемого электролита. Введение электролитов снижает высоту

потенциального барьера ΔUб, но при небольших концентрациях электролита энергетический барьер остается достаточно велик и коагуляции частиц не происходит. Агрегация наступает при введении определенного для данной системы количества электролита, соответствующего порогу коагуляции.
Слайд 10Коагуляция
Порог быстрой коагуляции Ск определяет количество электролита, необходимое для коагуляции единицы

объема коллоидной системы при полном исчезновении потенциального барьера ΔUб. При сохранении небольшого потенциального барьера в системе протекает медленная коагуляция.
Слайд 11Коагуляция
Закономерности электролитной коагуляции
Не все электролиты в одинаковой степени вызывают нарушение агрегативной

устойчивости ДС. Кроме того, коагулирующим действием обладает только один из ионов электролита.
Правило Шульце-Гарди: коагуляцию вызывают только те ионы, которые несут заряд, противоположный заряду гранулы (Гарди); коагулирующая способность ионов приблизительно пропорциональна шестой степени их заряда (Шульце).
Слайд 12Коагуляция
Коагулирующая способность ионов с одинаковым зарядом тоже неодинакова и возрастает с

увеличением радиуса ионов, т.е. с уменьшением гидратируемости их и, следовательно, с увеличением адсорбционной способности.
Ионы с одинаковым зарядом по своему коагулирующему действию располагаются в лиотропные ряды.
Слайд 13Коагуляция
Лиотропный ряд однозарядных катионов:
Сs+>Rb+> K+ > Na+ >Li+
Лиотропный ряд двухзарядных катионов:
Ba2+ >Sr2+

>Ca2+ >Mg2+
Лиотропный ряд катионов с разными зарядами:
Al3+> Ba2+ > Ca2+ > K+ > NH4+ > Na+
Лиотропный ряд однозарядных анионов:
CNS- > I- > NO3- >Br- > Cl-
Слайд 14Коагуляция
Закономерности нейтрализационной коагуляции
Правило Эйлерса-Корфа: при нейтрализационной коагуляции показатель степени при заряде

иона уменьшается до двух.
Слайд 15Коагуляция
Действие смесей электролитов
Возможны три случая:
Аддитивность – электролиты действуют как бы независимо друг

от друга, их коагулирующее действие суммируется. Наблюдается для электролитов сходных по коагулирующему действию.
Антогонизм – один из электролитов ослабляет действие другого и для коагуляции их необходимо больше, чем по правилу аддитивности. Характерен для электролитов сильно отличающихся по коагулирующему действию.
Синергизм – электролиты как бы способствуют друг другу, и для коагуляции их требуется меньше, чем по правилу аддитивности.
Слайд 16Коагуляция
Переход в золи осадков, полученных при коагуляции дисперсных систем, называется пептизацией. Процесс

обратный коагуляции.
Пептизация может происходить при удалении коагулянтов промыванием осадка чистой дисперсионной средой (пептизация промыванием), а также при введении в осадок некоторых электролитов или ПАВ, называемых пептизаторами (адсорбционная пептизация).
Слайд 17Пептизировать можно только свежие осадки (рыхлые).
Даже свежеполученные осадки при пептизации переходят в

свободнодисперсное состояние не полностью.
Слайд 18Коллоидная защита
Коллоидной защитой нызывается введение в коллоидную систему некоторых количеств ВМВ

или коллоидных ПАВ с целью повышения устойчивости данной системы.
Незащищенные ДС не переносят высокую температуру и не выдерживают удаление ДСр. Защищенные системы можно упаривать досуха, а затем снова перевести в коллоидное состояние добавлением растворителя; они не подчиняются правилу Шульце-Гарди и ведут себя как растворы защищающего вещества, т.е. приобретают свойства лиофильных ДС.
Слайд 19Коллоидная защита
Защитным действием обладают белки, полисахариды, мыла.
Механизм коллоидной защиты:
Макромолекулы ВМВ

адсорбируются на частицах ДФ, снижают поверхностное натяжение и образуют вместе со своими гидратными оболочками плотные поверхностные слои – возникают адсорбционно-сольватный и мощный структурно-механический факторы. Кроме того, если ВМВ имеют ионогенные группы, то они за счет диссоциации этих групп увеличивают и заряд частиц -электростатический фактор дополнительно усиливает структурно-механический фактор.
Слайд 20Коллоидная защита
Схемы защитного действия молекул ВМВ
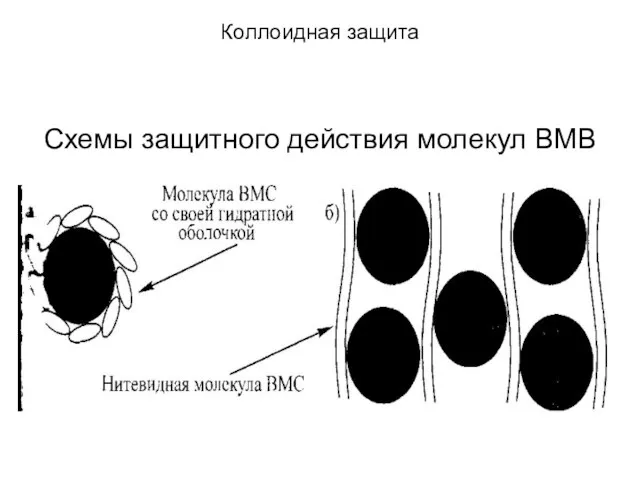
Слайд 21Коллоидная защита
Защитная способность ВМС или ПАВ относительно выбранного золя характеризуется защитным числом.
Защитное

число – это масса сухого защищающего вещества в миллиграммах, которую необходимо добавить к 10 мл золя, чтобы защитить его от коагуляции 1 мл раствора электролита определенной концентрации.
Вычисляют по формуле:
S = Cзв ∙ Vзв [мл], где Cзв – концентрация раствора защитного вещества, мг/мл; Vзв – объем раствора защитного вещества, необходимого для предотвращения коагуляции, мл.
Слайд 22Коллоидная защита
В организме защитными веществами являются белки крови, полисахариды, желчные кислоты

и другие биологически активные вещества. Уменьшение содержания этих веществ в биологических жидкостях вызывает различные патологические состояния. Защитные вещества активно участвуют в функционировании различных систем организма, так, способность крови удерживать в растворенном состоянии большое количество газов (кислорода и СО2) обусловлена защитным действием белков. Белки обволакивают микропузырьки этих газов и предохраняют их от слипания, препятствуя тем самым газовой эмболии сосудов.
Слайд 23Коллоидная защита
Большое значение защитное действие белков имеет в фармакологии. Например, при

изготовлении фармакологических бактерицидных препаратов колларгола и протаргола используется коллоидная защита. Эти препараты представляют собой концентрированные золи металлического серебра, защищенные от коагуляции добавкой декстринов и белковых веществ.
Слайд 24Коллоидная защита
Введение в организм лекарственного препарата в коллоидной форме, во-первых, локализует

его действие, во-вторых, позволяет ему действовать на больной орган сравнительно продолжительное время, так как вещество выводится из организма гораздо медленнее, чем если бы оно было введено в виде истинного раствора. При этом, бактерицидное действие колларгола и протаргола не экранируется белковой оболочкой, а распространяется на водную среду, окружающую частицы золей.
Слайд 25Задача
При диагностике гнойного менингита определяют защитное число (S) белков спинномозговой жидкости. Определите

это число, если известно, что для предотвращения коагуляции 20 мл золя AgBr при действии 2 мл 10%-го NaNO3 потребовалось добавить к этому золю 3 мл спинномозговой жидкости, содержащей 2 г белков в 1 л.
























 Классификация химических реакций. 11 класс
Классификация химических реакций. 11 класс Электроотрицательность
Электроотрицательность Соли. Свойства. Получение
Соли. Свойства. Получение Путешествие в мир кислот
Путешествие в мир кислот Стерилизация технологических потоков и оборудования
Стерилизация технологических потоков и оборудования Углеродные материалы. Основные понятия и определения. Области их применения
Углеродные материалы. Основные понятия и определения. Области их применения Техника безопасности на уроках химии
Техника безопасности на уроках химии Презентация на тему М.В. Ломоносов
Презентация на тему М.В. Ломоносов  Основи молекулярно-кінетичної теорії
Основи молекулярно-кінетичної теорії Материаловедение и технология конструкционных материалов
Материаловедение и технология конструкционных материалов Химия в загадках
Химия в загадках Неметаллы. Общая характеристика
Неметаллы. Общая характеристика Алмаз (С)
Алмаз (С) Окислительно – восстановительные реакции (урок химии в 11 классе)
Окислительно – восстановительные реакции (урок химии в 11 классе) Предельные углеводороды
Предельные углеводороды Производство полимеров в РК
Производство полимеров в РК Закон эквивалентов
Закон эквивалентов Теория строения химических соединений
Теория строения химических соединений Амины. Номенклатура аминов
Амины. Номенклатура аминов Язык естествознания. Химия
Язык естествознания. Химия Презентация на тему Химия и пища
Презентация на тему Химия и пища  01_Khimicheskiy_sostav
01_Khimicheskiy_sostav Процесс диссоциации
Процесс диссоциации Уравнение состояния идеального газа. Газовые законы. Изопроцессы
Уравнение состояния идеального газа. Газовые законы. Изопроцессы Общая характеристика галогенов на основе положения химических элементов в периодической системе
Общая характеристика галогенов на основе положения химических элементов в периодической системе Заполни электронные уровни элементов
Заполни электронные уровни элементов Презентация на тему Строение и свойства циклоалканов
Презентация на тему Строение и свойства циклоалканов  Физичекие явления - основа разделения смесей в химии. 17.09.21
Физичекие явления - основа разделения смесей в химии. 17.09.21