Содержание
- 2. Цель: эффективно повторить и обобщить знания, устранить отставание учащихся по теме «Алканы» Задачи : Повторить теорию;
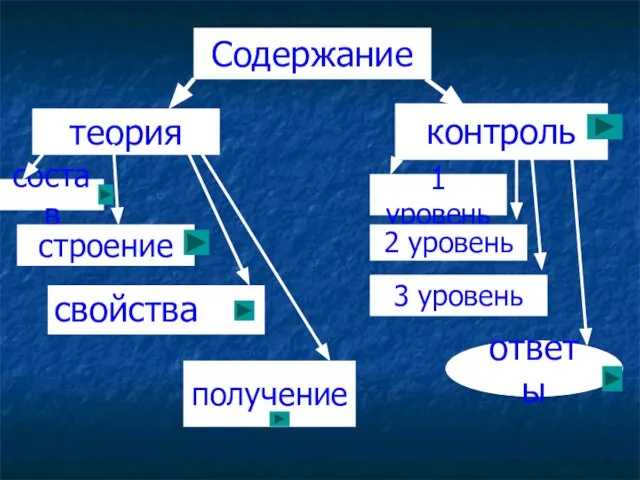
- 3. Содержание теория контроль состав строение получение 1 уровень 2 уровень 3 уровень ответы свойства
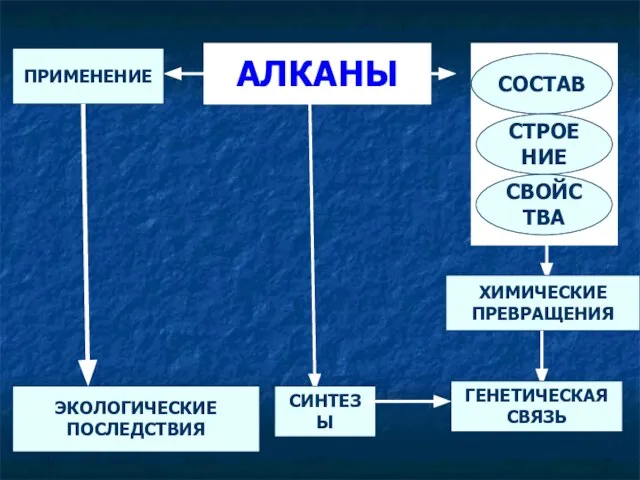
- 4. АЛКАНЫ СОСТАВ СТРОЕНИЕ СВОЙСТВА ПРИМЕНЕНИЕ ЭКОЛОГИЧЕСКИЕ ПОСЛЕДСТВИЯ СИНТЕЗЫ ХИМИЧЕСКИЕ ПРЕВРАЩЕНИЯ ГЕНЕТИЧЕСКАЯ СВЯЗЬ
- 5. Состав CH4 C2H6 C3H8 CnH2n+2 Гомологический ряд: CH4,C2H6,…..C8H18….C10H22 Метан, этан, ……..октан ……декан - ЭТО ВЕЩЕСТВА- ГОМОЛОГИ
- 6. Гомологи - вещества, сходные по строению и свойствам, состав которых отличается на одну или более групп
- 7. Гомологами являются : а) C2H6 и C2H4 б) в) C4H8 и C7H16 г) CH4 и C6H10
- 8. Определите формулы алканов: а) C5H10 б) C2H2 в) C7H16 г) C3 H8 Ответ: В,Г
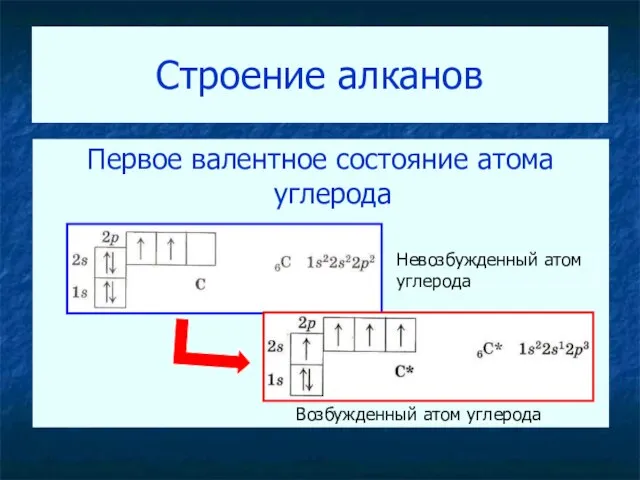
- 9. Строение алканов Первое валентное состояние атома углерода Невозбужденный атом углерода Возбужденный атом углерода
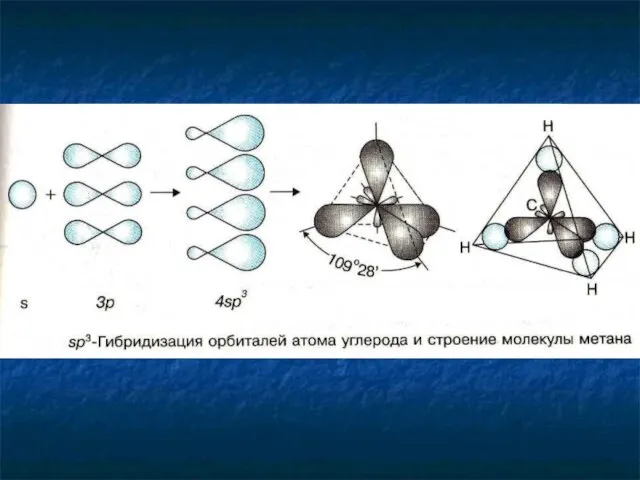
- 10. Гибридизация - «перемешивание» электронных облаков
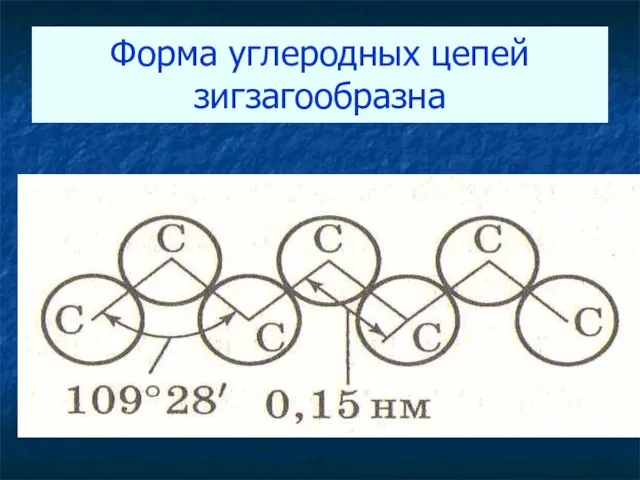
- 11. Форма углеродных цепей зигзагообразна
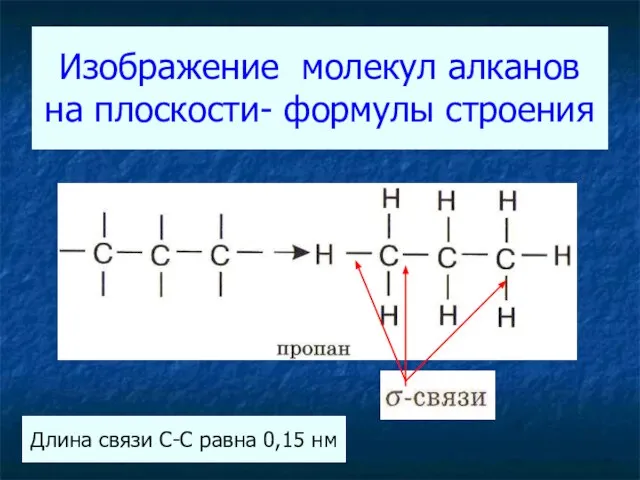
- 13. Изображение молекул алканов на плоскости- формулы строения Длина связи С-С равна 0,15 нм
- 14. ИЗОМЕРЫ ЭТО ВЕЩЕСТВА, ИМЕЮЩИЕ ОДИНАКОВЫЙ КАЧЕСТВЕННЫЙ СОСТАВ, СХОДНЫЕ ХИМИЧЕСКИЕ СВОЙСТВА, НО РАЗНОЕ СТРОЕНИЕ И РАЗЛИЧАЮЩИЕСЯ ПО
- 15. Сколько углеводородов изображено формулами? Ответ :а)один б)два в) три г) четыре Один ; это бутан
- 16. Номенклатура алканов Назовем алкан - 1.Выбираем самую длинную цепь атомов углерода и нумеруем ,начиная с того
- 17. 2.В начале названия перечисляют радикалы и другие заместители с указанием номеров атомов углерода, с которыми они
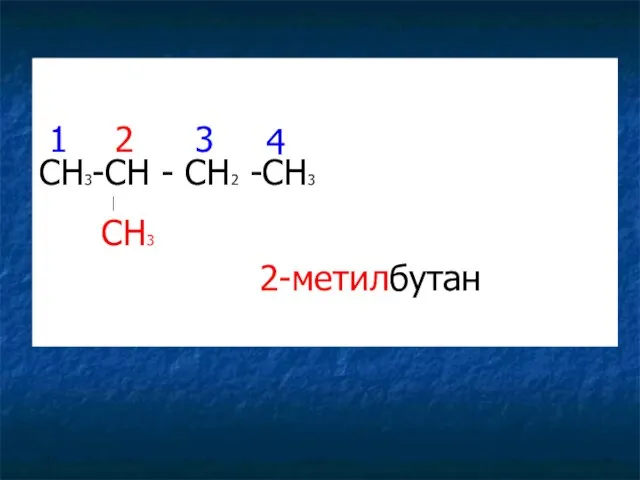
- 18. CH3-CH - CH2 -CH3 ⏐ CH3 1 2 3 4 2-метилбутан
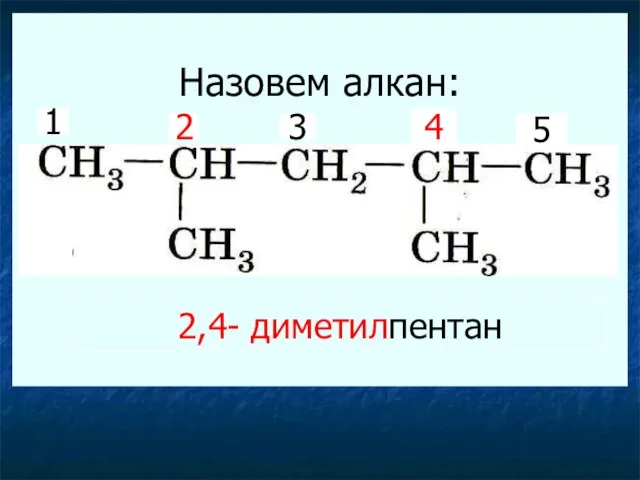
- 19. Назовем алкан: 1 2 3 4 5 2,4- диметилпентан
- 20. Название углеводорода с формулой: А)2,2,4-триметилгексан Б)5,5-диметил-3этилгексан В)2-диметил-4 этилгексан Г)2,2-диметил-4 этилгексан
- 21. Свойства алканов Физические химические С1- С4 - газы С5- С17 - жидкости с запахом бензина начиная
- 22. Химические превращения алканов обусловлены: 1. Разрывом цепи углеродных атомов. 2. Отрывом атомов водорода с последующим замещением
- 23. Галогенирование -радикальное замещение водорода на галоген (хлорирование и бромирование происходит под действием солнечного света, УФ-излучения, при
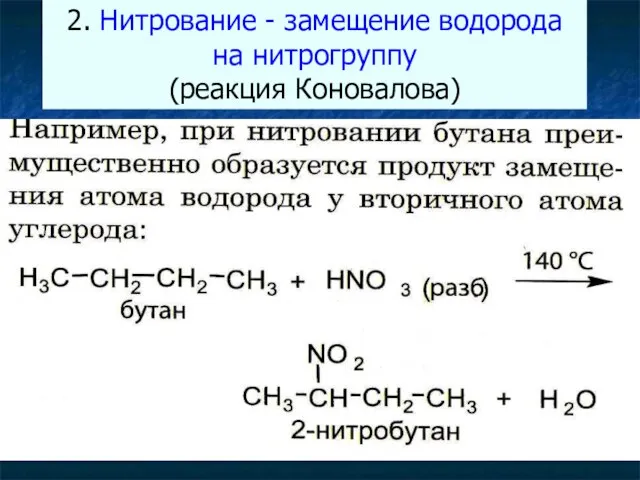
- 24. 2. Нитрование - замещение водорода на нитрогруппу (реакция Коновалова) CH4 + HNO3→CH3 - NO2 + H2O
- 25. 3. Изомеризация Использование хлорида алюминия при нагревании вызывает превращение алканов с нормальной цепью в их изомеры
- 26. 4.Крекинг - разрыв связей С - С , происходит при температуре свыше 400 градусов без доступа
- 27. 5. Дегидрирование - отщепление водорода; происходит при разных температурах (от300 до 600град.),на разных катализаторах: Ni, Pd,
- 28. 6. Риформинг (ароматизация) Если алкан содержит шесть или более атомов углерода, то дегидрирование может сопровождаться замыканием
- 29. 7. Горение Cn H2n +2 + (3 n + 1)/2 O2 → n CO2↑ + (n
- 30. 8.Конверсия метана CH4 + H2O катализатор, температура→CO+3H2 синтез-газ
- 31. 9.Каталитическое окисление бутана, метана
- 32. Синтезы алканов Природными источниками алканов (предельных углеводородов) являются: нефть, газ и горный воск. Химики открыли способы
- 33. 1. Гидрирование непредельных углеводородов (промышленный способ) (гидрированием называют реакции присоединения водорода по кратным связям); происходит в
- 34. 2. Реакция Фишера -Тропша (промышленный способ) Смесь предельных углеводородов от С6 до С12 под названием синтетический
- 35. 3. Реакция Вюрца (лабораторный способ) В 1855 г французский химик Ш.А.Вюрц разработал способ синтеза алканов путем
- 36. 4. Реакция Дюма - декарбоксилирование солей карбоновых кислот Эта реакция протекает при нагревании смеси порошков соли
- 37. 5. Реакция Кольбе- электролиз расплавов солей карбоновых кислот В ходе электролиза на аноде анионы CH3COO- окисляются
- 38. 6.Синтез метана из простых веществ При нагревании углерода в атмосфере водорода при температуре 400-500 градусов и
- 39. 7.Гидролиз карбида алюминия Al4 C3 + 12 H2O →4Al(OH)3+3CH4 На карбид можно действовать не только водой,
- 41. Контроль 1 Уровень. Воспроизведение знаний 1).Для вещества, имеющего строение CH3-CH - CH - CH3 ⏐ ⏐
- 42. 2). Напишите уравнения реакций: а) изомеризации бутана; б) горения пропана в кислороде; в) первой, второй и
- 43. 3). Решите задачу: Какая масса сажи образуется при разложении метана массой 24 ? Массовая доля выхода
- 44. 4). Решите задачу: Найдите молекулярную формулу углеводорода, если массовая доля углерода в нем равна 80%, плотность
- 45. 2 уровень. Применение знаний по образцу, в знакомой ситуации 1) Дано вещество - 2 метилбутан. Составьте
- 46. 2) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: CH4→CH3 Cl→C2H6→C2H5Br
- 47. 3) Решите задачу: При термическом разложении метана количеством вещества 14 моль получен ацетилен (С2Н2) ,объем которого
- 48. 4). Решите задачу: Найдите молекулярную формулу углеводорода, содержащего по массе 85,7% углерода и 14,3% водорода. Плотность
- 49. 3 уровень. Умение применять полученные знания в новой ситуации 1) Напишите уравнения реакций, с помощью которых
- 50. 2) Хлорэтан - газ, легко превращающийся в жидкость, которая при быстром испарении охлаждает кожу,что используют для
- 51. 3) В качестве хладагента в холодильниках наиболее широко используется дифтордихлорметан (фреон-1)- газ, легко переходящий в жидкое
- 52. 4) Решите задачу: При сгорании вещества массой 1,5 г образовались оксид углерода (IV) массой 4,4 г
- 53. Ответы I уровень № 3 -17,28 г № 4 - C2H6 II уровень № 3 -
- 55. Скачать презентацию










































 Основания. 8 класс
Основания. 8 класс Литий
Литий Теория химического строения органических веществ А.М. Бутлерова
Теория химического строения органических веществ А.М. Бутлерова Спирт и его влияние на организм человека
Спирт и его влияние на организм человека Фосфор, строение, свойства
Фосфор, строение, свойства Минералы. Определения, понятия
Минералы. Определения, понятия Свойства белков
Свойства белков Турнир знатоков химии
Турнир знатоков химии Коррозия металлов
Коррозия металлов Неорганическая и органическая химия
Неорганическая и органическая химия Ядро атома (тест)
Ядро атома (тест) Классификация аминокислот в зависимости от природы радикалов
Классификация аминокислот в зависимости от природы радикалов Смеси и взвеси веществ. Простейшие операции с веществом
Смеси и взвеси веществ. Простейшие операции с веществом 01_Khimicheskiy_sostav
01_Khimicheskiy_sostav 01. Химический состав
01. Химический состав Металлы
Металлы Химическое равновесие. Экзаменационные вопросы
Химическое равновесие. Экзаменационные вопросы Презентация на тему Дисперсные системы и растворы
Презентация на тему Дисперсные системы и растворы  Скорость химических реакций
Скорость химических реакций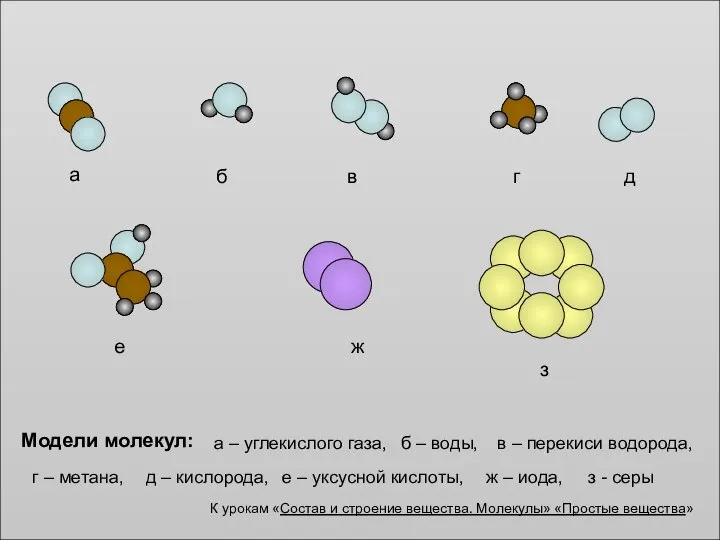 Модели молекул
Модели молекул Классификация органических соединений. Предельные углеводороды (УВ)
Классификация органических соединений. Предельные углеводороды (УВ) Великие ученые общей и неорганической химии
Великие ученые общей и неорганической химии Enantioselective Total Synthesis of (−)-Caldaphnidine O
Enantioselective Total Synthesis of (−)-Caldaphnidine O Введение в практическую деятельность
Введение в практическую деятельность Алкины
Алкины Методика исследования роста оксида кремния SiO2 c помощью РФЭС. Лекция 2
Методика исследования роста оксида кремния SiO2 c помощью РФЭС. Лекция 2 Изомерия
Изомерия Эффект растворителя при определении пространственной структуры сложных гетероциклических соединений
Эффект растворителя при определении пространственной структуры сложных гетероциклических соединений