Содержание
- 2. Какие физические величины можно использовать для определения меры следующих веществ? В каких единицах измеряются эти физические
- 3. Алмаз Раствор марганцовки Сера кристаллическая Масса (m) 1г = 10-3 кг 1кг = 103 г Объем
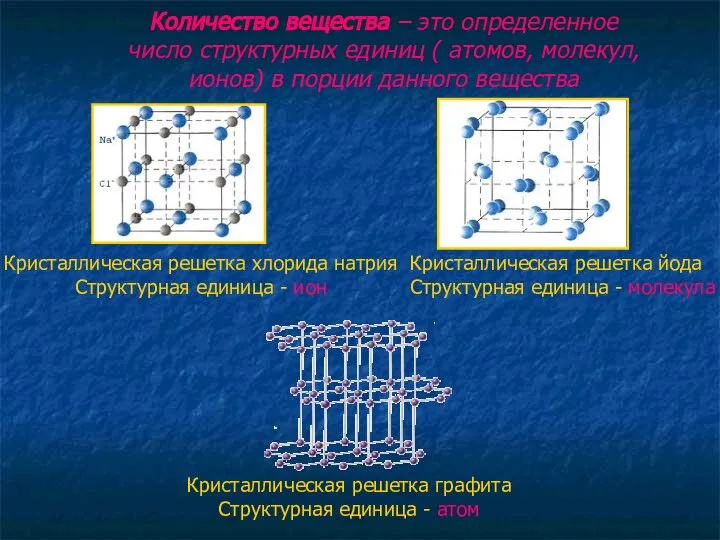
- 4. Количество вещества – это определенное число структурных единиц ( атомов, молекул, ионов) в порции данного вещества
- 5. Обозначение количества вещества Греческая буква ν Латинская буква n Произношение ню эн Единица измерения Моль
- 6. Объект Порции Куриное яйцо Десяток яиц
- 7. Объект Порции фотобумага Пакет фотобумаги (100 листов)
- 8. Объект Порция спичка Коробок (45 спичек)
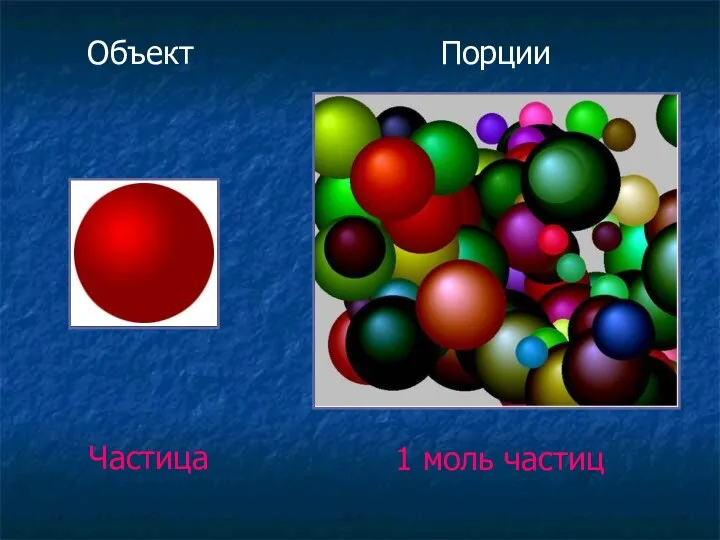
- 9. Объект Порции Частица 1 моль частиц
- 10. Моль от французского слова «moles»- множество Моль количество вещества, содержащее столько структурных частиц ( молекул, атомов,
- 11. Моль – это количество вещества, в котором содержится 6×10 23 частиц Число частиц в одном моль
- 12. 1 моль 6·1023 Сколько частиц содержится в 1 моль вещества?
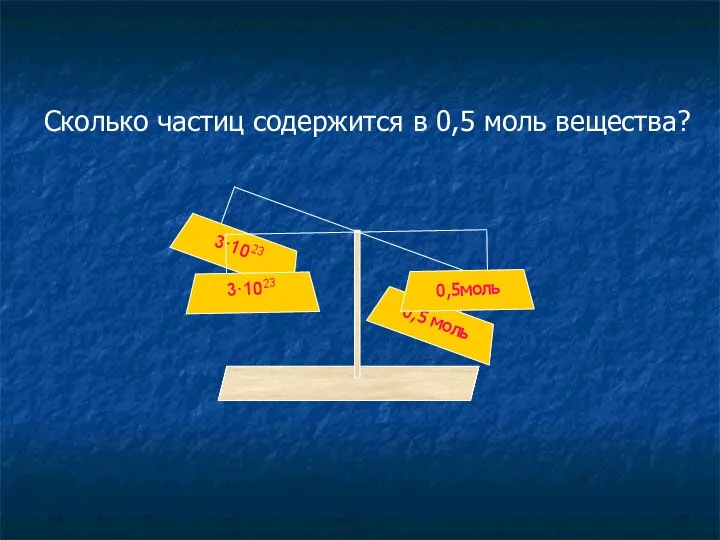
- 13. 0,5 моль 3·1023 Сколько частиц содержится в 0,5 моль вещества?
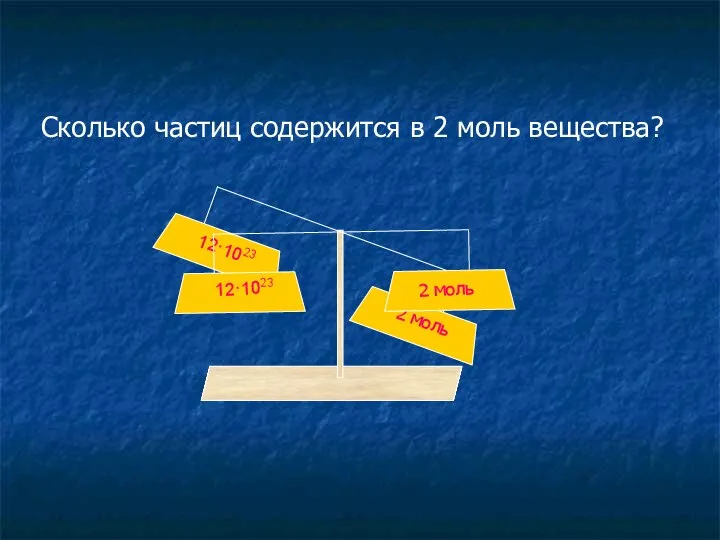
- 14. 2 моль 12·1023 Сколько частиц содержится в 2 моль вещества?
- 15. В стакан налито 3 столовых ложки воды. Одна столовая ложка – это примерно 1 моль воды.
- 16. N = Na× ν N – число структурных частиц ν =N/Na
- 17. В стандартном куске рафинированного сахара содержится 0,015 моль сахарозы. Сколько молекул сахарозы содержится в кусочке рафинада?
- 18. Сколько атомов содержит 4,5 моль меди? N(Cu) = 6×1023 1/моль× 4,5 моль = 27× 1023 атомов
- 19. SiO2 1 моль SiO2- это 6×1023 групп атомов 1 моль атомов Si (6·1023) 2 моль атомов
- 21. Скачать презентацию










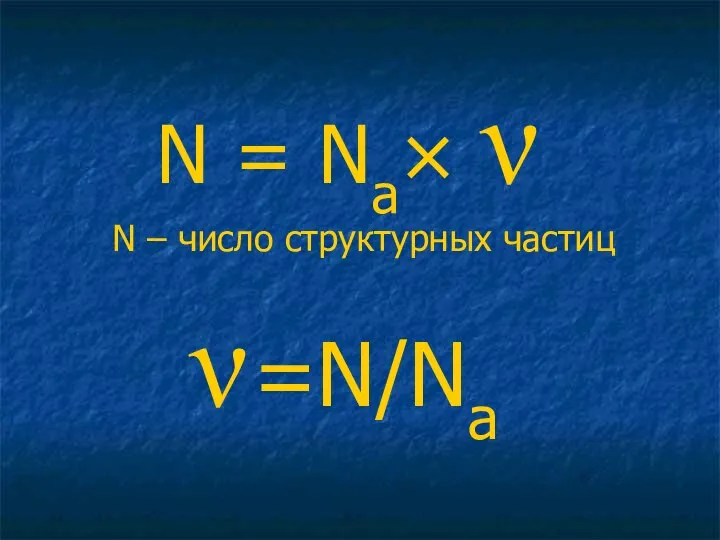



 Презентация на тему Коллоидная химия
Презентация на тему Коллоидная химия  История создания периодической таблицы
История создания периодической таблицы Химический элемент азот N и его соединения
Химический элемент азот N и его соединения Природные источники углеводородов. Природный и попутный нефтяные газы. Нефть. Каменный уголь
Природные источники углеводородов. Природный и попутный нефтяные газы. Нефть. Каменный уголь 10_kl_klas-ya
10_kl_klas-ya Взаимодействие частиц конденсированной фазы, их срастание (коалесценция). Лекция 3
Взаимодействие частиц конденсированной фазы, их срастание (коалесценция). Лекция 3 Входное тестирование по химии
Входное тестирование по химии Химические свойства кислот. 11 класс
Химические свойства кислот. 11 класс Определение формул органических веществ
Определение формул органических веществ Соли
Соли Средства ухода за кожей
Средства ухода за кожей Вывод химических формул
Вывод химических формул Презентация на тему Углеводороды (10 класс)
Презентация на тему Углеводороды (10 класс)  Белки
Белки Натуральный каучук
Натуральный каучук Типичные ошибки, допускаемые учащимися при выполнении задания повышенного уровня сложности С-5 ЕГЭ по химии
Типичные ошибки, допускаемые учащимися при выполнении задания повышенного уровня сложности С-5 ЕГЭ по химии Пространственная изомерия органических соединений
Пространственная изомерия органических соединений Презентация на тему Войди в природу другом
Презентация на тему Войди в природу другом  Периодическая система Д.И.Менделеева
Периодическая система Д.И.Менделеева Презентация на тему Катализ
Презентация на тему Катализ  Решение задач на определение массовой (объемной) доли выхода продукта реакции от теоретически возможного
Решение задач на определение массовой (объемной) доли выхода продукта реакции от теоретически возможного Перициклические реакции
Перициклические реакции Презентация на тему Углеводороды
Презентация на тему Углеводороды  Базы для кислых и щелочных сред
Базы для кислых и щелочных сред Химические методы количественного анализа веществ
Химические методы количественного анализа веществ АТФ - аденозинтрифосфорная кислота
АТФ - аденозинтрифосфорная кислота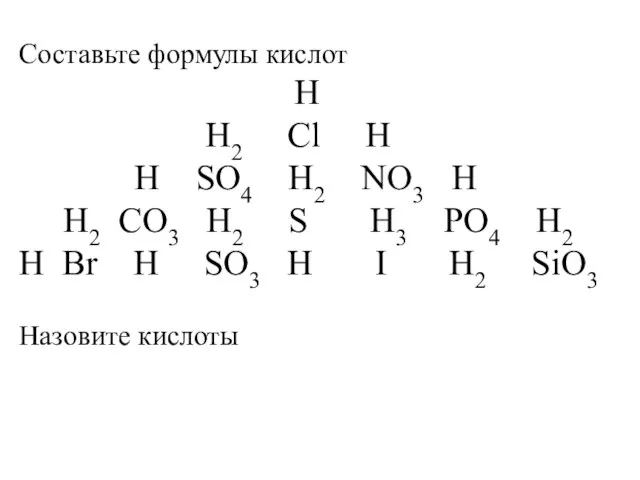 Составьте формулы кислот
Составьте формулы кислот Типы кристаллических решеток
Типы кристаллических решеток