Содержание
- 2. Галогены – элементы VIIА – группы. Галогены – типичные неметаллы. Общее название подгруппы «галогены», т.е. «рождающие
- 3. Строение и свойства атомов. Галогены: фтор F, хлор Cl, бром Br, йод I, астат At (редко
- 4. Галогены – простые вещества. Все галогены существуют в свободном состоянии в виде двухатомных молекул с ковалентной
- 6. Скачать презентацию
Слайд 2Галогены – элементы VIIА – группы. Галогены – типичные неметаллы. Общее название
Галогены – элементы VIIА – группы. Галогены – типичные неметаллы. Общее название

подгруппы «галогены», т.е. «рождающие соли».
Галогены.
Слайд 3Строение и свойства атомов.
Галогены: фтор F, хлор Cl, бром Br, йод I,
Строение и свойства атомов.
Галогены: фтор F, хлор Cl, бром Br, йод I,

астат At (редко встречающийся в природе) – типичные неметаллы. Их атомы содержат на внешнем энергетическом уровне семь электронов, и им недостает лишь одного электрона, чтобы завершить его. Атомы этих элементов при взаимодействии с металлами принимают электрон от атомов металлов. При этом возникает ионная связь и образуются соли.
Галогены – очень сильные окислители. Фтор в химических реакциях проявляет только окислительные свойства, и для него характерна степень окисления -1. Остальные галогены могут проявлять и восстановительные свойства при взаимодействии с более электроотрицательными элементами – фтором, кислородом, азотом, при этом степени их окисления могут принимать значения +1, +3, +5, +7. восстановительные свойства галогенов усиливаются от хлора к йоду, что связано с ростом радиусов их атомов: атомы хлора примерно вдвое меньше, чем у йода.
Галогены – очень сильные окислители. Фтор в химических реакциях проявляет только окислительные свойства, и для него характерна степень окисления -1. Остальные галогены могут проявлять и восстановительные свойства при взаимодействии с более электроотрицательными элементами – фтором, кислородом, азотом, при этом степени их окисления могут принимать значения +1, +3, +5, +7. восстановительные свойства галогенов усиливаются от хлора к йоду, что связано с ростом радиусов их атомов: атомы хлора примерно вдвое меньше, чем у йода.
Слайд 4Галогены – простые вещества.
Все галогены существуют в свободном состоянии в виде
Галогены – простые вещества.
Все галогены существуют в свободном состоянии в виде

двухатомных молекул с ковалентной неполярной химической связью между атомами. В твердом состоянии F2, Cl2, Br2, I2 имеют молекулярные кристаллические решетки, что и подтверждается их физическими свойствами.
- Предыдущая
Музыкальная азбукаСледующая -
Скорость химической реакции Открытый урок химии. Типы химических реакций
Открытый урок химии. Типы химических реакций Клеящие материалы
Клеящие материалы Влияние инициаторов на реакцию полимеризации стирола
Влияние инициаторов на реакцию полимеризации стирола Презентация на тему Озоновая дыра
Презентация на тему Озоновая дыра  Влияние бытовой химии на здоровье человека
Влияние бытовой химии на здоровье человека Аммиак. Строение молекулы. Водородная связь
Аммиак. Строение молекулы. Водородная связь Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Презентация на тему Виды химической связи и типы кристаллических решеток
Презентация на тему Виды химической связи и типы кристаллических решеток 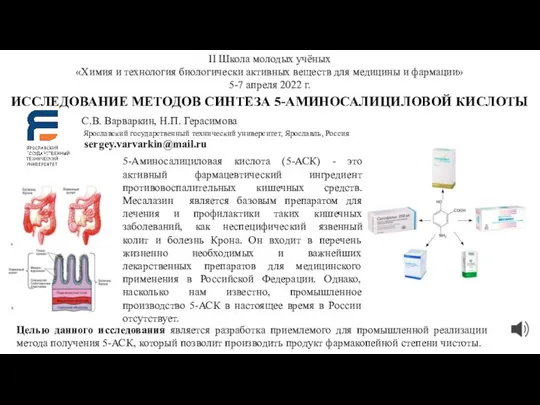 Исследование методов синтеза 5-аминосалициловой кислоты
Исследование методов синтеза 5-аминосалициловой кислоты Расчет печи кипящего слоя в производстве хлорида калия
Расчет печи кипящего слоя в производстве хлорида калия Арены. Бензол
Арены. Бензол Предмет органическая химия. Теория строения органических веществ
Предмет органическая химия. Теория строения органических веществ Химическая связь. Строение вещества
Химическая связь. Строение вещества Полімери. Пінополістирол
Полімери. Пінополістирол Полимеры и пластмассы
Полимеры и пластмассы Гидролиз солей
Гидролиз солей Липиды. Источники
Липиды. Источники Атом. Ядро и электронная оболочка. Изотопы. Строение электронных оболочек атома. Понятие об орбиталях
Атом. Ядро и электронная оболочка. Изотопы. Строение электронных оболочек атома. Понятие об орбиталях Химические свойства основных классов неорганических соединений
Химические свойства основных классов неорганических соединений Системно-деятельностный подход в обучении химии
Системно-деятельностный подход в обучении химии Кремний и его соединения
Кремний и его соединения Типы реакций в неорганической химии. Гидролиз. Электролиз
Типы реакций в неорганической химии. Гидролиз. Электролиз Гетероциклические соединения. Пятичленные гетероциклы с одним гетероатомом
Гетероциклические соединения. Пятичленные гетероциклы с одним гетероатомом Поликонденсация. Особенности процесса
Поликонденсация. Особенности процесса Получение и примененипе радиоактивные изотопы
Получение и примененипе радиоактивные изотопы Предельные углеводороды. Тест 19
Предельные углеводороды. Тест 19 Круговорот азота в природе
Круговорот азота в природе Разбор домашнего задания
Разбор домашнего задания