Содержание
- 2. Спирты – это производные углеводородов, где один или несколько водородных атомов замещены на гидроксогруппу.
- 3. Гомологический ряд спиртов
- 4. Функциональная группа спиртов При смещении электронной плотности от водорода к кислороду, возможна некоторая подвижность атома водорода,
- 5. Водородная связь Уменьшение расстояния между молекулами спиртов приводит к тому, что среди спиртов нет газообразных Веществ,
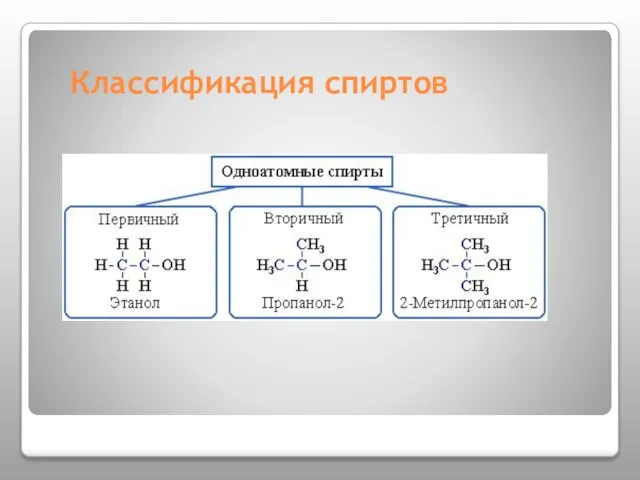
- 6. Классификация спиртов
- 8. Номенклатура спиртов Систематические названия даются по названию углеводорода с добавлением суффикса -ол и цифры, указывающей положение
- 9. Изомерия спиртов 1. Для спиртов характерна структурная изомерия: изомерия положения ОН-группы (начиная с С3) 2. углеродного
- 10. Химические свойства спиртов 1. Взаимодействие с галогеноводородами, подобно взаимодействию щелочей с кислотами 2. Дегидратация. А) внутримолекулярная
- 11. Б) межмолекулярная 3. Горение С2Н5ОН + 3 О2 → 2 СО2 + 3 Н2О С3Н7ОН +
- 12. 4. Спирты взаимодействуют со щелочными и щелочно-земельными металлами 2СН3-СН2-ОН + 2К → 2СН3-СН2-ОК + Н2 2СН3-СН2-ОН
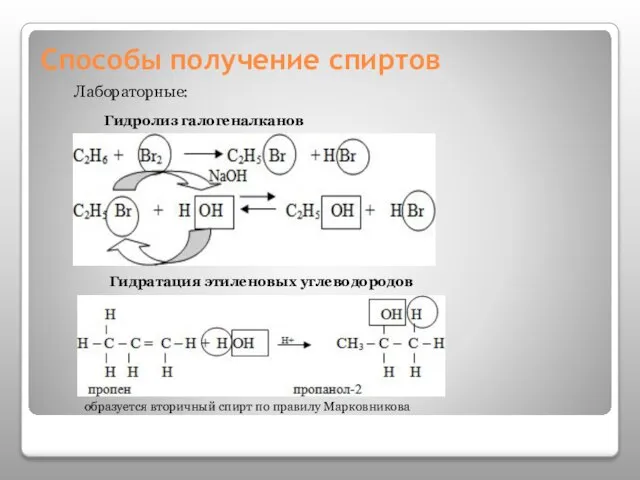
- 13. Способы получение спиртов Лабораторные: Гидролиз галогеналканов Гидратация этиленовых углеводородов образуется вторичный спирт по правилу Марковникова
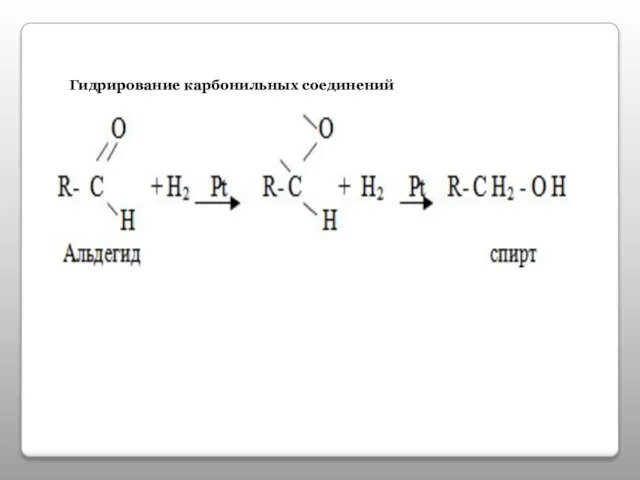
- 14. Гидрирование карбонильных соединений
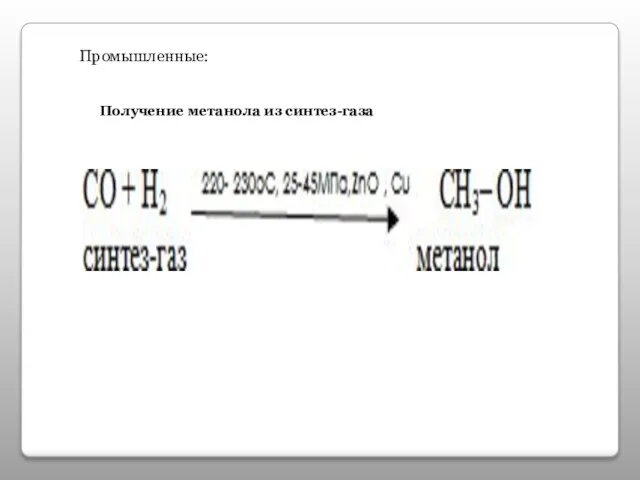
- 15. Промышленные: Получение метанола из синтез-газа
- 16. Применение спиртов Получение лекарств
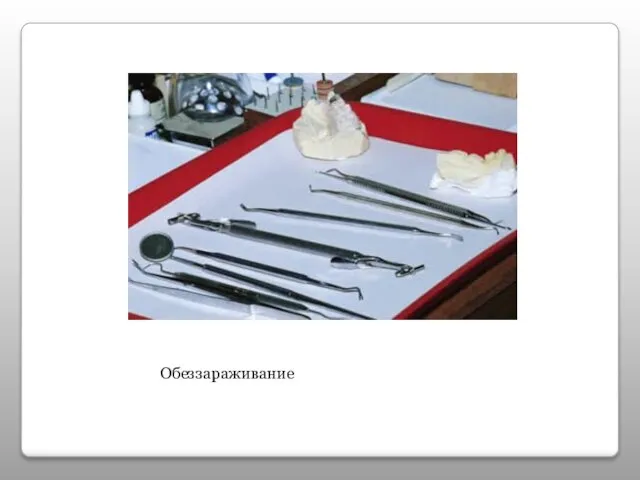
- 17. Обеззараживание
- 18. Производство лаков и красок
- 19. При проведении клинического анализа крови
- 20. В качестве автомобильного топлива
- 21. Как добавка к реактивному топливу
- 22. В качестве растворителя
- 23. Сырье для получения каучука
- 24. Сырье для производства уксусной кислоты
- 25. Проверь себя 1. Общая формула предельных одноатомных спиртов а) CnH2n+2 б) CnH2n в) CnH2n-2 г) CnH2n+1OH
- 26. 2. Функциональная группа предельных одноатомных спиртов а) - СНО б) - СООН в) - ОН г)
- 27. 3. Реакции по разрыву связи в гидроксогруппе а) с галогенами; б) с кислородом; в) с активными
- 28. Реакция с отрывом гидроксогруппы а) окисление; б) гидрирование; в) гидратация; г) дегидратация (+)
- 30. Скачать презентацию






















 Все о пище с точки зрения химии
Все о пище с точки зрения химии Физико-химические основы получения лекарственных препаратов
Физико-химические основы получения лекарственных препаратов ГИА по химии 2010-2011
ГИА по химии 2010-2011 Виготовлення водних розчинів з заданою масовою часткою розчиненої речовини
Виготовлення водних розчинів з заданою масовою часткою розчиненої речовини Растворение
Растворение Обозначения групп симметрии по Шенфлису
Обозначения групп симметрии по Шенфлису Учение о химических процессах. Лекция 3
Учение о химических процессах. Лекция 3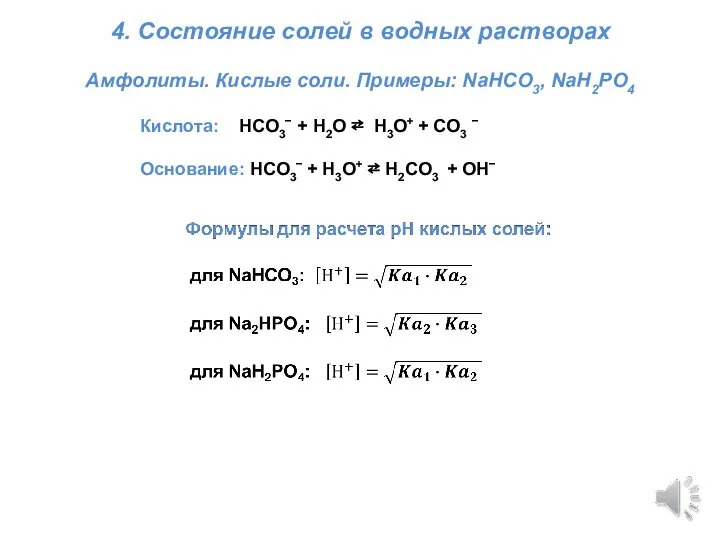 Титриметрия. Состояние солей в водных растворах
Титриметрия. Состояние солей в водных растворах Ковалентная полярная химическая связь
Ковалентная полярная химическая связь Alkini
Alkini Атом. Будова атома
Атом. Будова атома Физико-химические свойства нефтепродуктов
Физико-химические свойства нефтепродуктов Коррозия металлов (9 класс)
Коррозия металлов (9 класс) Взаимодействие молекул (7 класс)
Взаимодействие молекул (7 класс) Основы молекулярно - кинетической теории
Основы молекулярно - кинетической теории Азот. Аммиак. Соли аммония (1)
Азот. Аммиак. Соли аммония (1) Тақырыпқа байланысты білімді жүйелеу
Тақырыпқа байланысты білімді жүйелеу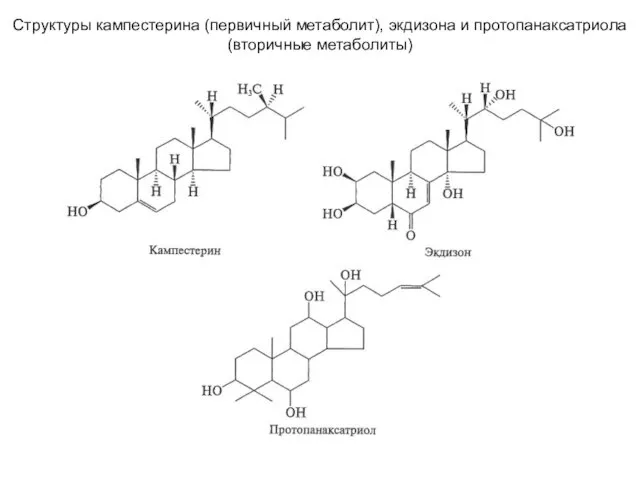 Структуры кампестерина (первичный метаболит), экдизона и протопанаксатриола (вторичные метаболиты)
Структуры кампестерина (первичный метаболит), экдизона и протопанаксатриола (вторичные метаболиты) Фосфор. Тест по химии для 9 класса
Фосфор. Тест по химии для 9 класса Менделеев Дмитрий Иванович
Менделеев Дмитрий Иванович Закон сохранения массы и энергии
Закон сохранения массы и энергии Валентность химических элементов. Определение валентности элементов по формулам их соединений
Валентность химических элементов. Определение валентности элементов по формулам их соединений Основания. Растворимые (гидроксиды щелочных и щелочноземельных металлов). Нерастворимые
Основания. Растворимые (гидроксиды щелочных и щелочноземельных металлов). Нерастворимые Презентация на тему Химия в промышленности
Презентация на тему Химия в промышленности  Коррозия металлов
Коррозия металлов Подгруппа азота
Подгруппа азота Биосинтез пиримидиновых нуклеотидов
Биосинтез пиримидиновых нуклеотидов Презентация на тему Белки. Строение и свойства
Презентация на тему Белки. Строение и свойства