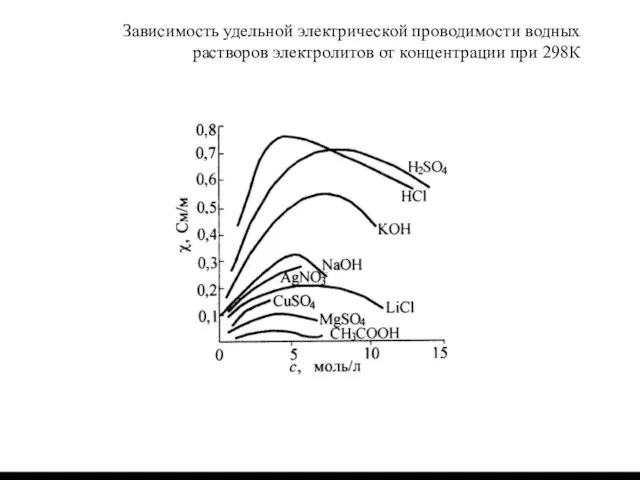
Слайд 2Зависимость удельной электрической проводимости водных растворов электролитов от концентрации при 298К
Слайд 4Особенности растворов сильных электролитов
активность иона
a(H+)=[H+]= γ·c(экв)
![Особенности растворов сильных электролитов активность иона a(H+)=[H+]= γ·c(экв)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/872942/slide-3.jpg)
Слайд 7ионное произведение воды
рН + рОН = 14
[H+] · [OH-] = 10-14
![ионное произведение воды рН + рОН = 14 [H+] · [OH-] = 10-14](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/872942/slide-6.jpg)
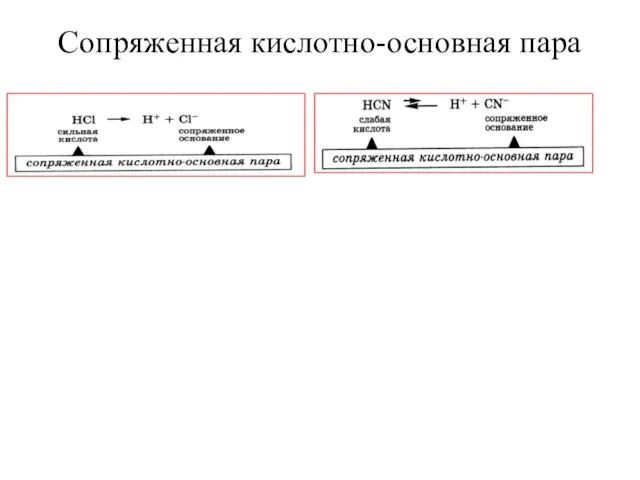
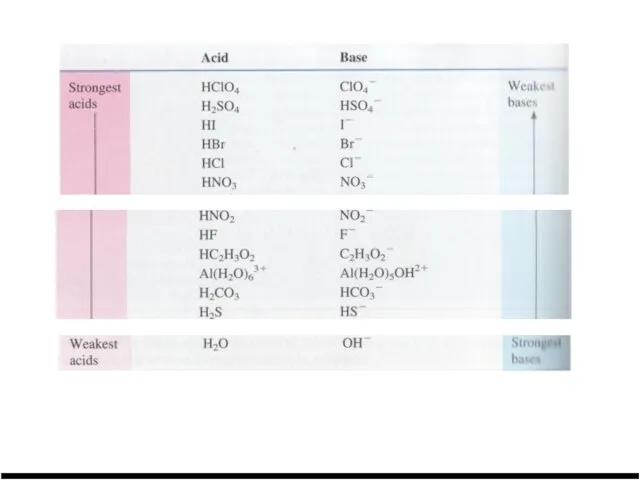
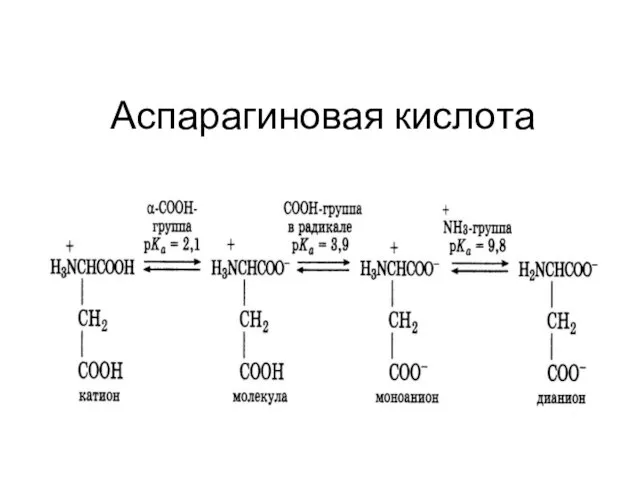
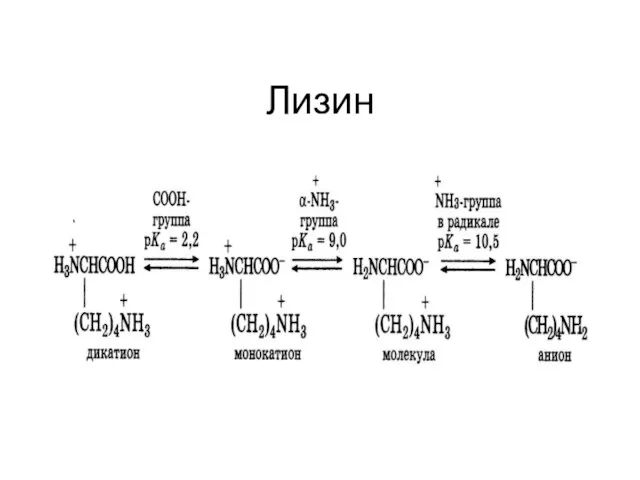
Слайд 10Сопряженная кислотно-основная пара
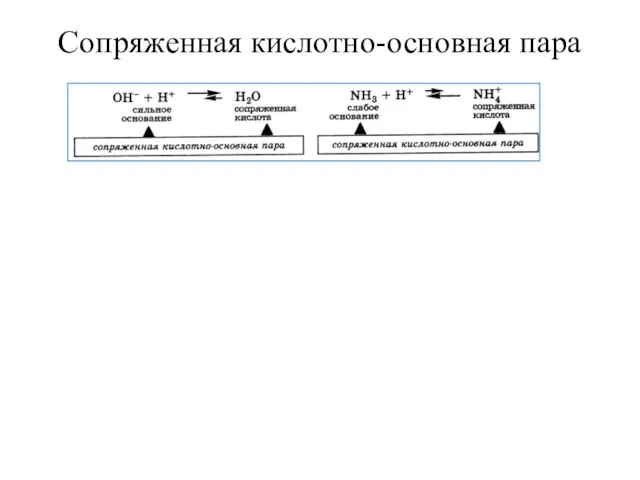
Слайд 11Сопряженная кислотно-основная пара
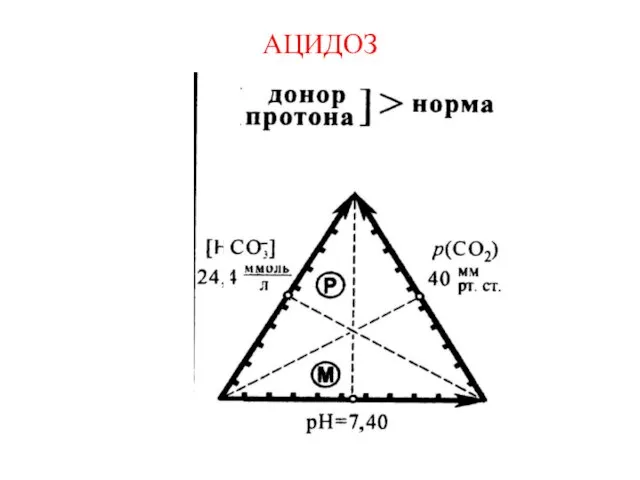
Слайд 16Активная, общая и потенциальная кислотность

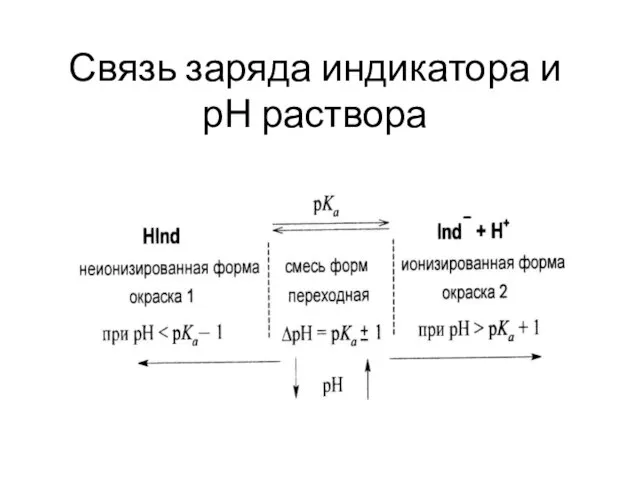
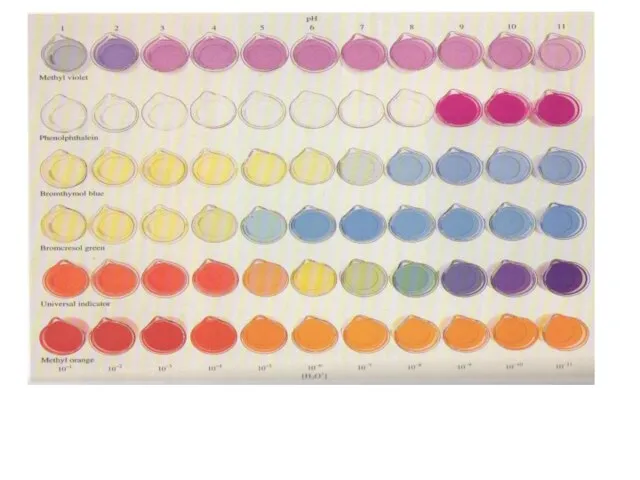
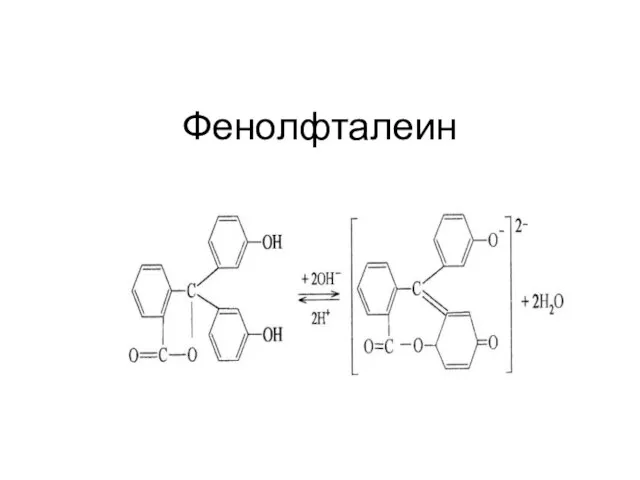
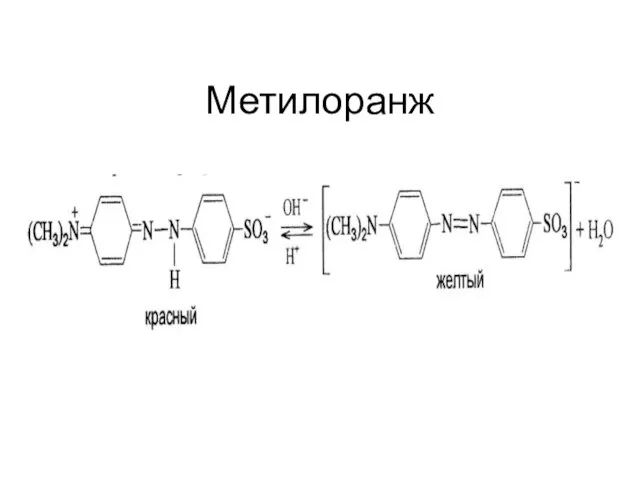
Слайд 21Связь заряда индикатора и
рН раствора
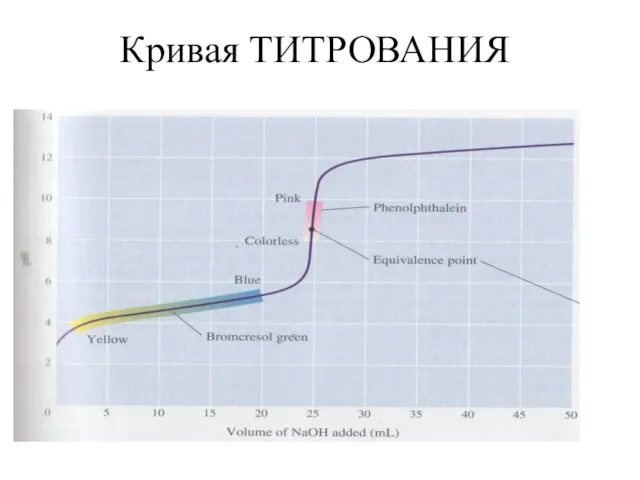
Слайд 25Кислотно-основные
буферные системы

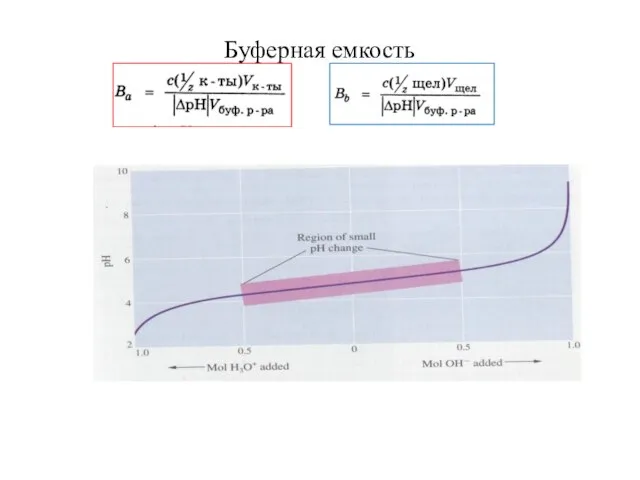
Слайд 26Уравнение ГЕНДЕРСОНА-ХАССЕЛЬБАХА
для кислотного буфера
для основного буфера

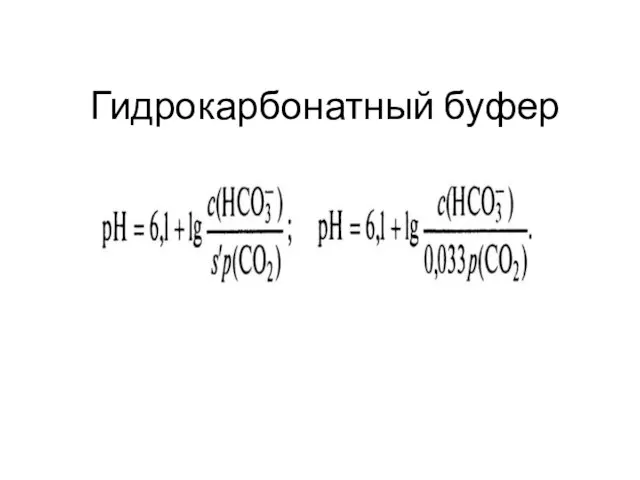
Слайд 28Буферные системы организма
1. Гидрокарбонатная
2.Гидрофосфатная
3.Гемоглобиновая
4.Белковая

Слайд 32Относительный вклад буферных систем крови в поддержание протолитического гомеостаза



![Особенности растворов сильных электролитов активность иона a(H+)=[H+]= γ·c(экв)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/872942/slide-3.jpg)

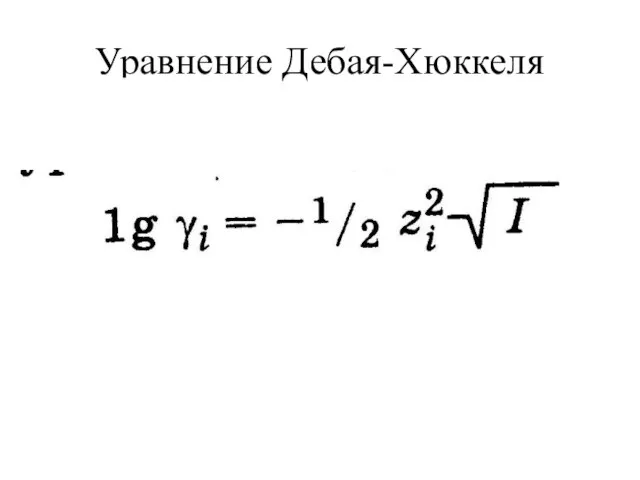
![ионное произведение воды рН + рОН = 14 [H+] · [OH-] = 10-14](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/872942/slide-6.jpg)














 Алканы, алкены, алкины
Алканы, алкены, алкины Уравнение состояния идеального газа
Уравнение состояния идеального газа Обобщение и систематизация знаний по теме Углеводороды
Обобщение и систематизация знаний по теме Углеводороды Предельные углеводороды. Алканы (1)
Предельные углеводороды. Алканы (1) Процессы минералообразования
Процессы минералообразования Степени окисления и формулы веществ
Степени окисления и формулы веществ Решение экспериментальных задач по теме Металлы
Решение экспериментальных задач по теме Металлы Изготовление слайма в домашних условиях
Изготовление слайма в домашних условиях Основы химии полимеров
Основы химии полимеров Альдегиды, их химические и физические свойства. Получение и применение альдегидов
Альдегиды, их химические и физические свойства. Получение и применение альдегидов Азот
Азот Химические свойства основных классов неорганических соединений
Химические свойства основных классов неорганических соединений Металлы
Металлы Кремний и его соединения
Кремний и его соединения Теория электролитической диссоциации. Ионные уравнения. Задания
Теория электролитической диссоциации. Ионные уравнения. Задания Развитие творческих способностей школьников на уроках химии
Развитие творческих способностей школьников на уроках химии Нефть. Способы переработки нефти
Нефть. Способы переработки нефти Кислоты. 8 класс
Кислоты. 8 класс Количественный анализ
Количественный анализ Роль химии в решении экологических проблем
Роль химии в решении экологических проблем Про краски
Про краски Соли. Химические свойства
Соли. Химические свойства Кислоты. Номенклатура. Классификация
Кислоты. Номенклатура. Классификация Ароматические кислородсодержащие соединения
Ароматические кислородсодержащие соединения Презентация на тему Серебро
Презентация на тему Серебро  Современные сплавы на основе циркония
Современные сплавы на основе циркония Химический диктант как метод формирующего оценивания
Химический диктант как метод формирующего оценивания Вода в природе
Вода в природе