Содержание
- 20. Запишем и запомним!
- 21. Линия 29 Для выполнения задания используйте следующий перечень веществ: перманганат калия, гидрокарбонат натрия, сульфит натрия, сульфат
- 22. Анализ задания 31 Перманганат калия, гидрокарбонат натрия, сульфит натрия, сульфат бария, гидроксид калия, пероксид водорода. Перманганат
- 23. Сульфит натрия (или сера в степени окисления ) является восстановителем. Перманганат калия (или марганец в степени
- 24. Линия 32 1.Нитрат марганца (II) прокалили, к полученному твердому бурому веществу прилили концентрированную хлороводородную кислоту. Выделившийся
- 25. Линия 32 2. Бурый осадок, полученный при взаимодействии сульфита натрия с водным раствором перманганата калия, отфильтровали
- 26. Закрепление 1. Закончить уравнения реакций: а) Mn + H2SO4 (разб.) = …; б) MnCl2 + KOH
- 28. Скачать презентацию

























 Проект синтеза бензина для промышленных целей отделения Д-3 цеха Д 2-6-3-5-12
Проект синтеза бензина для промышленных целей отделения Д-3 цеха Д 2-6-3-5-12 Степени окисления химических элементов в соединениях
Степени окисления химических элементов в соединениях Алкены. Непредельные углеводороды
Алкены. Непредельные углеводороды Строение , свойства и биологическая роль гликолипидов. Тема 14
Строение , свойства и биологическая роль гликолипидов. Тема 14 Алканы. Физические свойствава алканов
Алканы. Физические свойствава алканов Химия как наука. Краткая история развития химии. Значение химии
Химия как наука. Краткая история развития химии. Значение химии Важнейшие классы неорганических соединений
Важнейшие классы неорганических соединений Диаграммы состояния двухкомпонентных систем типа твердое тело – жидкость
Диаграммы состояния двухкомпонентных систем типа твердое тело – жидкость Полимеры и пластмассы
Полимеры и пластмассы Блок колонн на установке замедленного коксования производительностью 730000 тонн/год гудрона (поз.к-1, кх-1)
Блок колонн на установке замедленного коксования производительностью 730000 тонн/год гудрона (поз.к-1, кх-1) Ионная связь
Ионная связь Метаболизм липидов
Метаболизм липидов Адамсит. Дигидрофенарсазинхлорид HN(C6H4)2AsCl
Адамсит. Дигидрофенарсазинхлорид HN(C6H4)2AsCl Задача 11 Ртутное сердце Команда: Мастера Беспорядка
Задача 11 Ртутное сердце Команда: Мастера Беспорядка Окислительно=восстановительное титрование
Окислительно=восстановительное титрование Альдегиды. Строение молекул
Альдегиды. Строение молекул Алгебраический метод решения задач В-9 – элемент решения задач С4
Алгебраический метод решения задач В-9 – элемент решения задач С4 Расчет равновесного состояния системы натрий-кислород-водород, для энергетических ядерных реакторов
Расчет равновесного состояния системы натрий-кислород-водород, для энергетических ядерных реакторов Презентация на тему Хлор
Презентация на тему Хлор  Классификация коррозионных процессов металлов
Классификация коррозионных процессов металлов Классификация и номенклатура ОС
Классификация и номенклатура ОС Путешествие в мир кислот
Путешествие в мир кислот Строение и химические свойства галогенов
Строение и химические свойства галогенов Знакомый и незнакомый углерод (9 класс)
Знакомый и незнакомый углерод (9 класс) Термореактивные пластмассы (реактопласты)
Термореактивные пластмассы (реактопласты)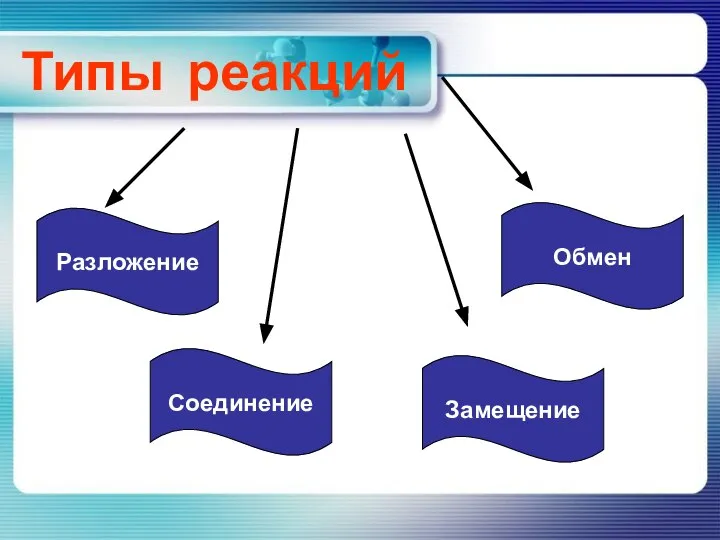 Реакции разложения
Реакции разложения Определение степеней окисления и расстановка коэффициентов в ОВР
Определение степеней окисления и расстановка коэффициентов в ОВР Понятие о предельных углеводородах. Алканы
Понятие о предельных углеводородах. Алканы