Содержание
- 2. План. Определение. Общая формула класса углеводородов. Гомологический ряд. Виды изомерии. Строение алканов. Физические свойства. Способы получения.
- 3. Алканы. (Предельные углеводороды. Парафины. Насыщенные углеводороды.) Алканы - углеводороды в молекулах которых все атомы углерода связаны
- 4. Гомологический ряд метана СН4 метан С2H6 этан C3H8 пропан C4H10 бутан C5H12 пентан C6H14 гексан C7H16
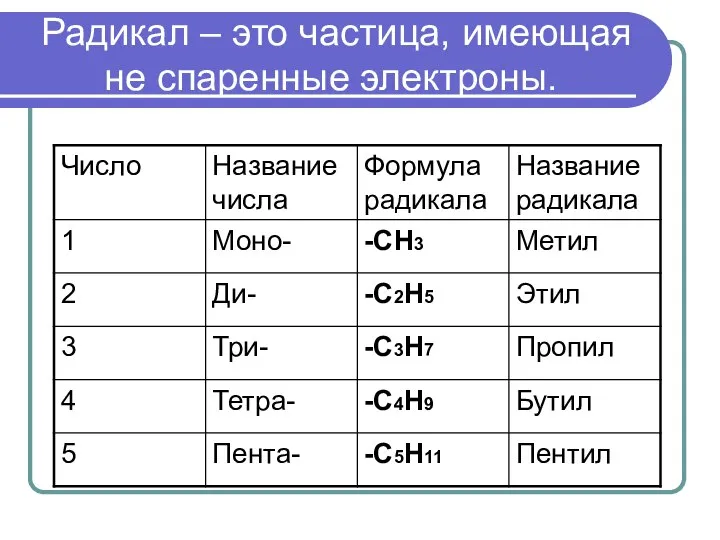
- 5. Радикал – это частица, имеющая не спаренные электроны.
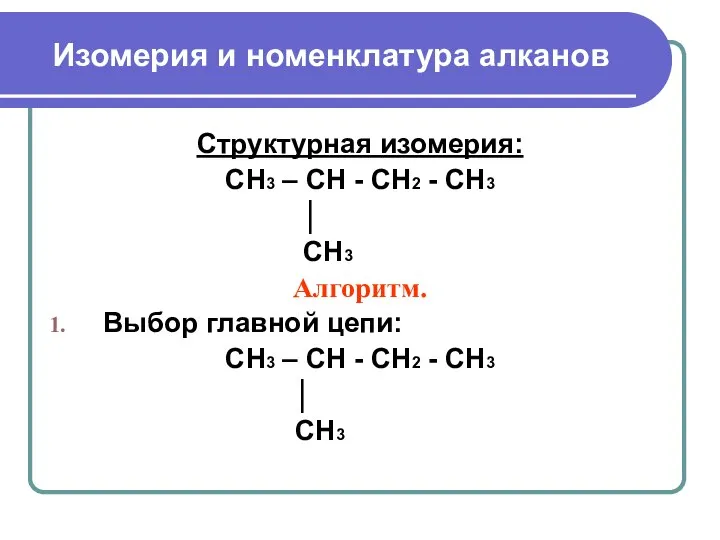
- 6. Изомерия и номенклатура алканов Структурная изомерия: CH3 – CH - CH2 - CH3 │ CH3 Алгоритм.
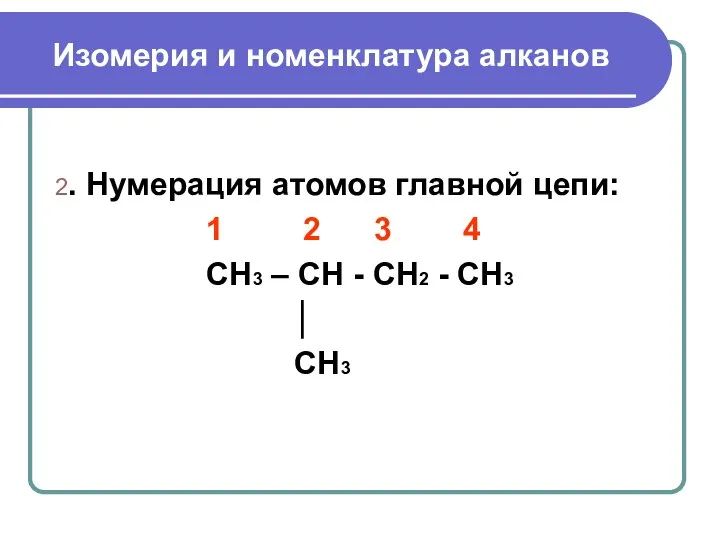
- 7. Изомерия и номенклатура алканов 2. Нумерация атомов главной цепи: 1 2 3 4 CH3 – CH
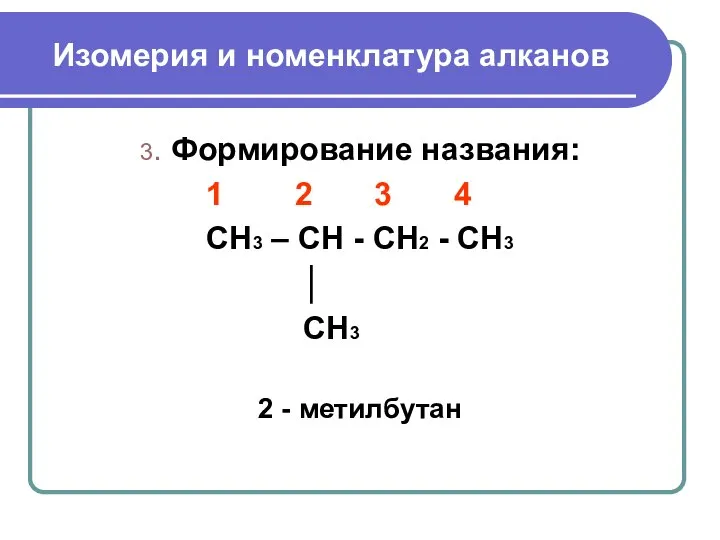
- 8. Изомерия и номенклатура алканов 3. Формирование названия: 1 2 3 4 CH3 – CH - CH2
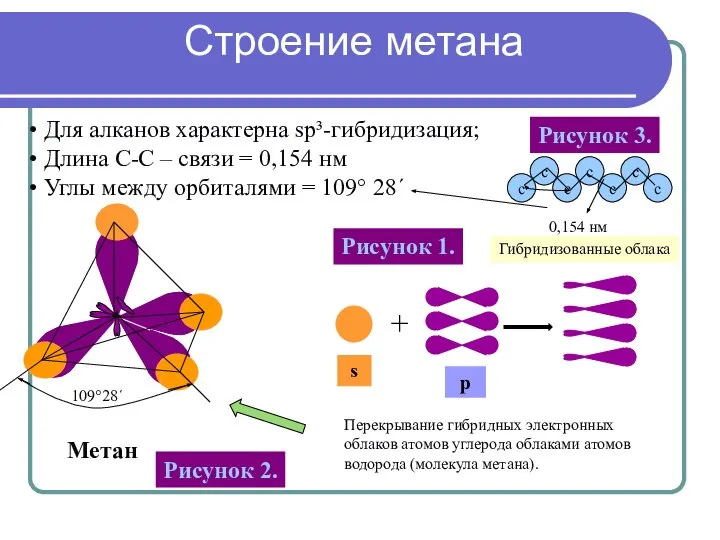
- 9. Метан Для алканов характерна sp³-гибридизация; Длина С-С – связи = 0,154 нм Углы между орбиталями =
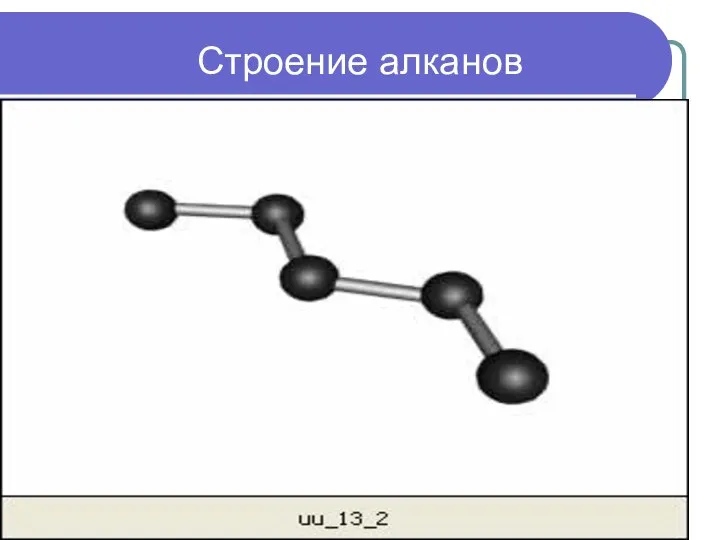
- 10. Строение алканов
- 11. Физические свойства С увеличением относительных молекулярных масс предельных углеводородов закономерно повышаются их температуры кипения и плавления.
- 12. В промышленности: а) крекинг нефтепродуктов: C16H34 → C8H18 + C8H16 2) В лаборатории: в) Декарбоксилирование натриевых
- 13. Получение метана
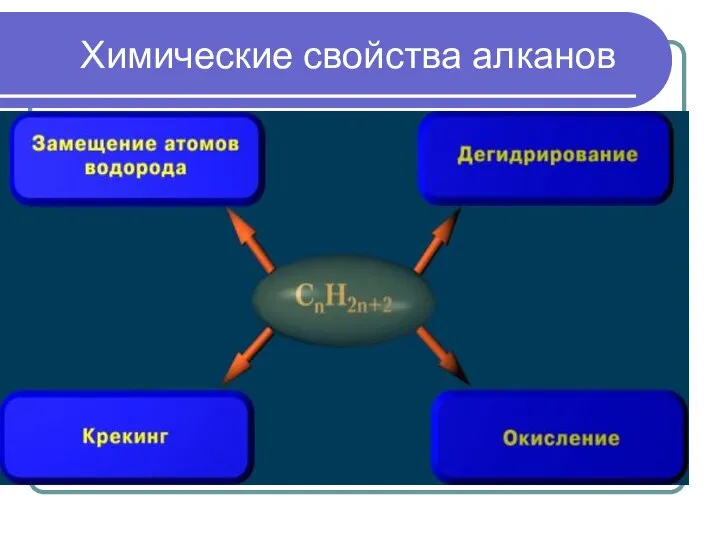
- 14. Химические свойства алканов
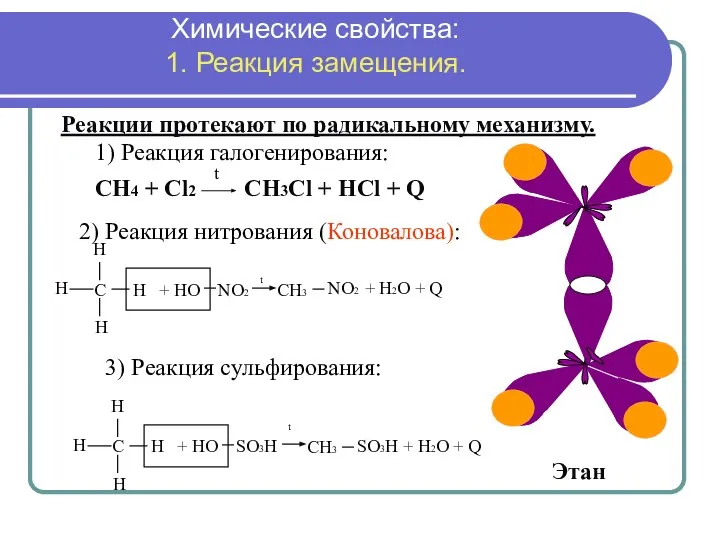
- 15. СН4 + Сl2 CH3Cl + HCl + Q t Реакции протекают по радикальному механизму. Этан б)
- 16. 2. Реакции изомеризации: СН3 СН2 СН2 СН2 СН3 t, катализатор СН3 СН СН2 СН3 СН3 3.Реакции
- 17. 6. Реакция горения: CH4 + 2O2 → CO2 + 2H2O + Q
- 18. Широко используются в качестве топлива, в том числе для двигателей внутреннего сгорания. Применение алканов
- 19. Применение алканов 1-3 – производство сажи (1 – картриджи; 2 – резина; 3 – типографическая краска)
- 20. Закрепление. Составьте все возможные изомеры для гептана и назовите их. Составьте 2 ближайших гомолога для пентана
- 22. Скачать презентацию











 Дисперсные системы. Тест
Дисперсные системы. Тест Неметаллы
Неметаллы Лабораторно-практическое занятие № 5. Неметаллические материалы
Лабораторно-практическое занятие № 5. Неметаллические материалы Биогенный элемент. Кобальт (Со)
Биогенный элемент. Кобальт (Со) Общие свойства неметаллов
Общие свойства неметаллов Презентация на тему Теория строения органических соединений А. М. Бутлерова
Презентация на тему Теория строения органических соединений А. М. Бутлерова  Химическая связь
Химическая связь Вычисление массовой доли элемента в молекуле
Вычисление массовой доли элемента в молекуле Гидролиз солей
Гидролиз солей Кислотные оксиды
Кислотные оксиды Простые вещества – неметаллы
Простые вещества – неметаллы Алканы. Зачетная работа
Алканы. Зачетная работа Нефтяные дисперсные системы
Нефтяные дисперсные системы Презентация на тему ОВР в органической химии 11 класс
Презентация на тему ОВР в органической химии 11 класс  Основные классы неорганических соединений. Общие формулы оксидов, оснований, кислот, солей. 8 класс
Основные классы неорганических соединений. Общие формулы оксидов, оснований, кислот, солей. 8 класс Stereoselective total syntheses of guanacastepenes N and O
Stereoselective total syntheses of guanacastepenes N and O Водород
Водород Презентация на тему Гормоны
Презентация на тему Гормоны  Физико-химические процессы в гидросфере
Физико-химические процессы в гидросфере Атомы, вещества, молекулы
Атомы, вещества, молекулы Химические свойства и получение спиртов
Химические свойства и получение спиртов Презентация на тему Химия в повседневной жизни человека
Презентация на тему Химия в повседневной жизни человека  Интеллектуальные игры. Химия
Интеллектуальные игры. Химия Углеводы
Углеводы Вычисление массовой доли химического элемента в веществе
Вычисление массовой доли химического элемента в веществе Химия элементов (лекция 4)
Химия элементов (лекция 4) Презентация на тему Карбоновые кислоты
Презентация на тему Карбоновые кислоты  Метаболизм триацилглицеринов
Метаболизм триацилглицеринов