Содержание
- 2. Растворы Дисперсные системы – это системы, состоящие из сплошной среды (называемой дисперсионной средой) с распределенным в
- 3. Переменность состава можно связать с концентрацией. Напомним основные выражения концентраций. 1. Объемная молярная концентрация – количество
- 4. a Г1 c d Г2 b H2O xC4H9OH tret-C4H9OH Ограниченная растворимость. Можно ввести понятие предельной концентрации
- 5. Ассоциация (от лат. associare — соединять) — объединение простых молекул или ионов в более сложные, (почти)
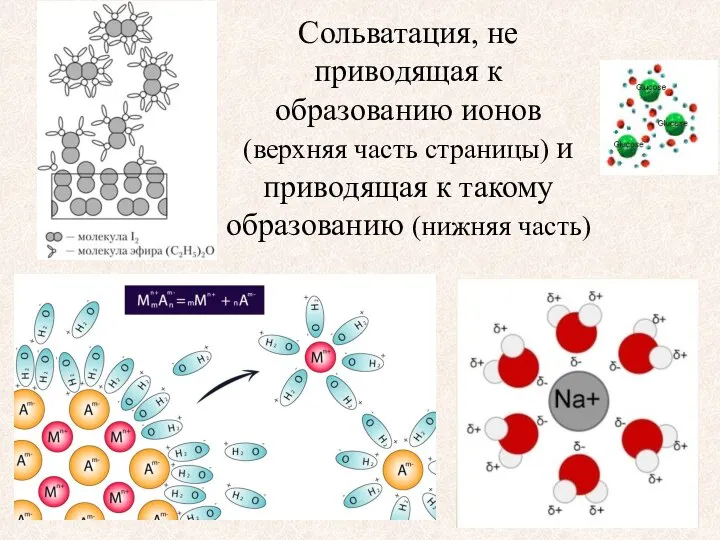
- 6. Сольватация, не приводящая к образованию ионов (верхняя часть страницы) и приводящая к такому образованию (нижняя часть)
- 7. Электролитическая ионизация (диссоциация) Процесс распада растворенного вещества на ионы под действием растворителя называется электролитической ионизацией или
- 8. Электролитическая ионизация (диссоциация) Доказательства реальности ионизации (продолжение) 2. Выводы из экспериментов по изучению коллигативных свойств растворов
- 9. Количественные характеристики электролитической ионизации (диссоциации) 1. Степень ионизации (ионизации) α. где – количество распавшихся молекул, а
- 10. Итак, ионизации AwBz = wAz+ + zBw- Пример: (1) (2) Связь между степенью ионизации α и
- 11. Для более простых (и более часто встречающихся) равновесий вида AB = A+ + B– получаем .
- 12. Из вопросов определения концентраций различных ионов выделяется своей важностью вопрос об определении концентраций ионов водорода (СH+).
- 13. В каких пределах может изменяться pH? Для ответа на вопрос рассмотрим самоионизацию воды. H2O = H+
- 15. Скачать презентацию











 Кальций, железо. Горение стальной ваты и железного порошка
Кальций, железо. Горение стальной ваты и железного порошка Биологически важные вещества. Бифункциональные соединения. Аминокислоты, пептиды, белки
Биологически важные вещества. Бифункциональные соединения. Аминокислоты, пептиды, белки Основания как электролиты
Основания как электролиты Химические свойства кислот с точки зрения ТЭД
Химические свойства кислот с точки зрения ТЭД Химический анализ
Химический анализ Презентация на тему Генетическая связь между классами неорганических вещ-в
Презентация на тему Генетическая связь между классами неорганических вещ-в  Термодинамика живого объекта. Основы биоэнергетики. Лекция 2
Термодинамика живого объекта. Основы биоэнергетики. Лекция 2 Презентация на тему Типы изомерии
Презентация на тему Типы изомерии  Закон сохранения массы веществ
Закон сохранения массы веществ Энергетический обмен
Энергетический обмен Исследование фазовых и структурных превращений в железе и его сплавах магнитным методом
Исследование фазовых и структурных превращений в железе и его сплавах магнитным методом Водород в природе. Получение водорода и его физические свойства. 8 класс
Водород в природе. Получение водорода и его физические свойства. 8 класс Железо и его соединения. Строение атома железа
Железо и его соединения. Строение атома железа Неорганические вещества
Неорганические вещества Галогенпроизводные алканов. Методы получения
Галогенпроизводные алканов. Методы получения Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Гидроксикарбоновые кислоты
Гидроксикарбоновые кислоты Изучение адсорбции аминокислот на поверхности гидроксилапатита при варьировании рН
Изучение адсорбции аминокислот на поверхности гидроксилапатита при варьировании рН Турнир Деда Мороза. Викторина по химии
Турнир Деда Мороза. Викторина по химии Классификация сложных неорганических веществ. Оксиды
Классификация сложных неорганических веществ. Оксиды Очистка поваренной соли методом кристаллизации в домашних условиях
Очистка поваренной соли методом кристаллизации в домашних условиях Свойства алмаза
Свойства алмаза Неметаллы. Агрегатные состояния неметаллов
Неметаллы. Агрегатные состояния неметаллов Изучение пенопласта
Изучение пенопласта Презентация по химии на тему _Высокомолекулярные Соединения_ (1)
Презентация по химии на тему _Высокомолекулярные Соединения_ (1) Интерактивная интеллектуальная игра. Юный химик
Интерактивная интеллектуальная игра. Юный химик Схема реакций
Схема реакций Путешествие в мир кислот
Путешествие в мир кислот