Содержание
- 2. ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ (А Л К А Н Ы)
- 3. ЦЕЛИ УРОКА: Продолжить формирование умения составлять структурные формулы предельных углеводородов Познакомиться с физическими, химическими свойствами, строением,
- 4. АЛКАНЫ - углеводороды, в молекулах которых атомы связаны одинарными связями и которые соответствуют общей формуле СnН2n+2
- 5. СТРОЕНИЕ АЛКАНОВ
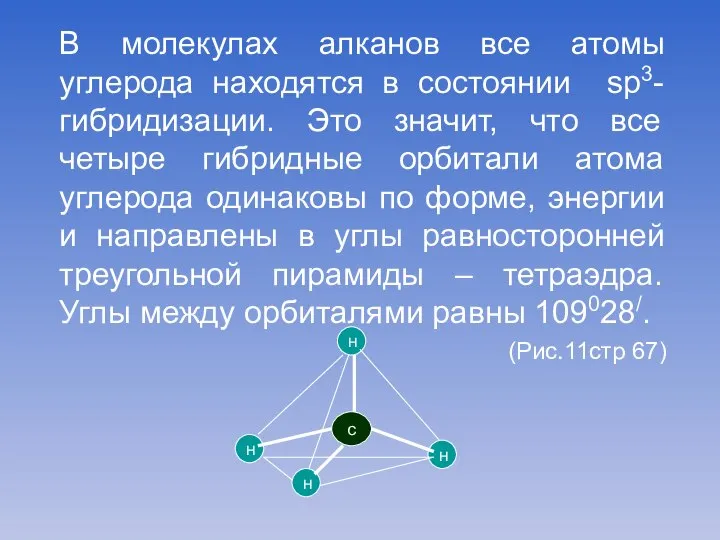
- 6. В молекулах алканов все атомы углерода находятся в состоянии sp3-гибридизации. Это значит, что все четыре гибридные
- 7. Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение, и молекулы алканов могут приобретать самую разнообразную форму.
- 8. Все связи в молекулах алканов одинарные, перекрывание происходит по оси, соединяющей ядра атомов,то есть сигма-связи. Связи
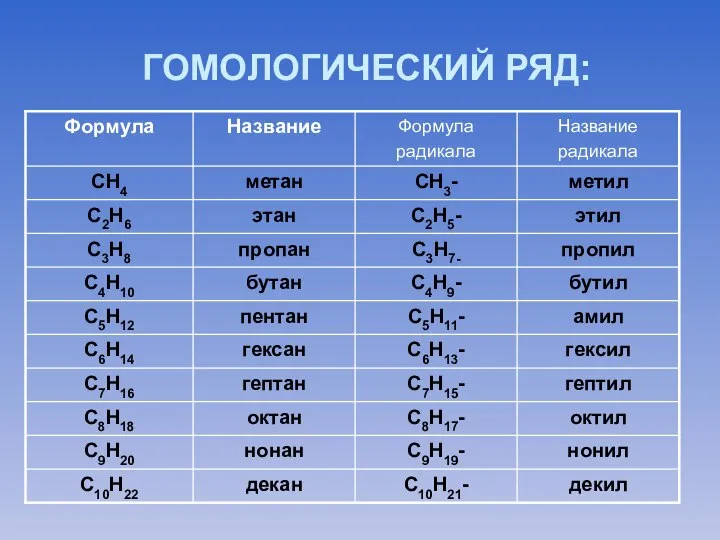
- 9. ГОМОЛОГИЧЕСКИЙ РЯД:
- 10. Ряд веществ, расположенных в порядке возрастания относительных молекулярных масс, сходных по строению и свойствам, но отличающихся
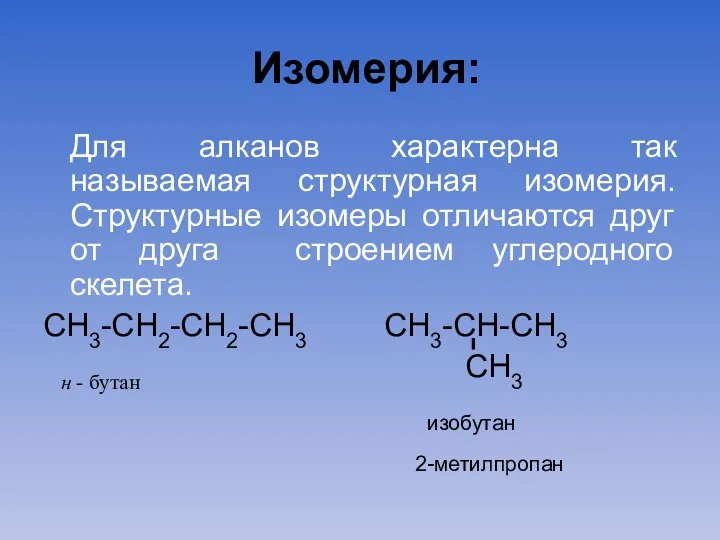
- 11. Изомерия: Для алканов характерна так называемая структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного
- 12. НОМЕНКЛАТУРА: Выбор главной цепи (самая длинная цепочка атомов углерода в молекуле) Нумерация атомов главной цепи (начинается
- 13. 3. Формирование названия ( в начале названия указывают цифры – номера атомов углерода, при которых находятся
- 14. ПОЛУЧЕНИЕ: Выделение углеводородов из природного сырья Источники природных углеводородов –нефть и природный газ. Основной компонент природного
- 15. ФИЗИЧЕСКИЕ СВОЙСТВА: Первые четыре представителя гомологического ряда – газы. Метан – газ без цвета, вкуса и
- 16. Химические свойства: Реакция замещения – галогенирование СН4 + Cl2 = СН3Cl + НCl, если избыток галогена,
- 17. Дегидрирование (отщепление водорода) При пропускании алканов над катализатором (Pt, Ni, Al2O3, Cr2O3) при высокой температуре (400
- 18. Применение: Предельные углеводороды, в особенности метан находят широкое применение в промышленности ( схема 2 стр. 79).
- 19. Выполните задания, которые указаны на карточках.
- 21. Скачать презентацию















 2.Химич. м-ды колич. ан-за
2.Химич. м-ды колич. ан-за Скорость химических реакций
Скорость химических реакций Термодинамика
Термодинамика Круговорот азота
Круговорот азота Классы неорганических веществ
Классы неорганических веществ Строение вещества
Строение вещества Генетическая связь неорганических соединений
Генетическая связь неорганических соединений Химия – наука, преобразующая мир для учеников. 7-8 классов
Химия – наука, преобразующая мир для учеников. 7-8 классов Модель Андерсона
Модель Андерсона Азотная кислота
Азотная кислота Презентация на тему Неорганические соединения. Периодическая таблица Д.И.Менделеева
Презентация на тему Неорганические соединения. Периодическая таблица Д.И.Менделеева  Первоначальные химические понятия. 2 раунд
Первоначальные химические понятия. 2 раунд Понятие биотехнологии
Понятие биотехнологии Органика в ЕГЭ (В,С)
Органика в ЕГЭ (В,С) Ренгеноструктурный и рентгеноспектральный анализы
Ренгеноструктурный и рентгеноспектральный анализы Адсорбция. Механизмы адсорбции. Термодинамика адсорбции. Лекция 5
Адсорбция. Механизмы адсорбции. Термодинамика адсорбции. Лекция 5 Опасность вещества поливинилхлорида
Опасность вещества поливинилхлорида Композиційні матеріали на основі функціоналізованих олігодієнів, вінілових мономерів і наповнювачів різної природи
Композиційні матеріали на основі функціоналізованих олігодієнів, вінілових мономерів і наповнювачів різної природи Соли
Соли Эвапориты. Химические осадки из ионных растворов
Эвапориты. Химические осадки из ионных растворов Реакции этерификации
Реакции этерификации Строение атома. История открытия
Строение атома. История открытия Кислород. Применение и круговорот в природе. 8 класс
Кислород. Применение и круговорот в природе. 8 класс Нахождение молекулярной формулы по данным о массовых долях элементов и относительной молекулярной массе (или молярной массе)
Нахождение молекулярной формулы по данным о массовых долях элементов и относительной молекулярной массе (или молярной массе) Тестирование по химии
Тестирование по химии Роль радикальных процессов. Свободные формы кислорода. Пероксидное окисление липидов
Роль радикальных процессов. Свободные формы кислорода. Пероксидное окисление липидов Мило. Вищі карбонові кислоти
Мило. Вищі карбонові кислоти Образование растворов ВМС
Образование растворов ВМС