Содержание
- 2. Термин «катализатор» предложен шведским химиком Берцелиусом в 1835 году применительно к веществам которые существенно ускоряют скорость
- 3. Крупнейший отечественный специалист в области катализа Георгий Константинович Боресков сформулировал понятие «катализ» как «…возбуждение химических реакций
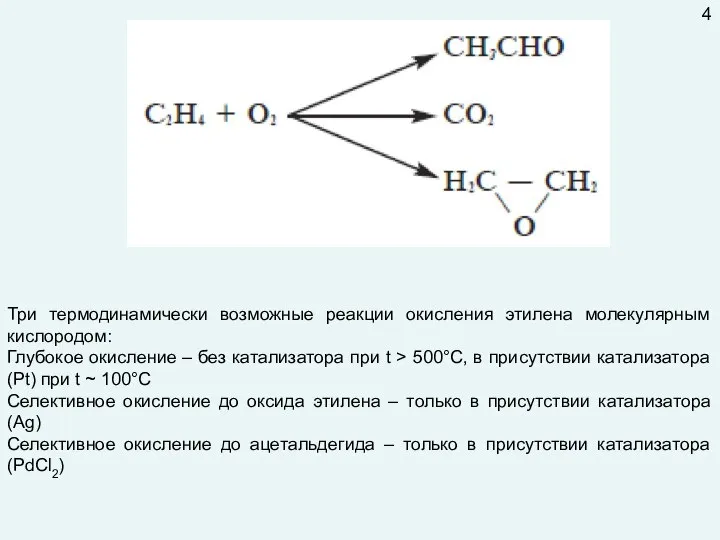
- 4. Три термодинамически возможные реакции окисления этилена молекулярным кислородом: Глубокое окисление – без катализатора при t >
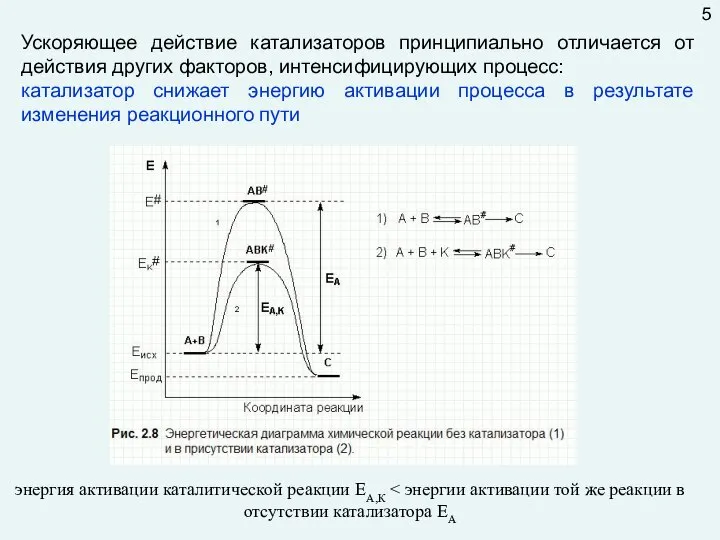
- 5. Ускоряющее действие катализаторов принципиально отличается от действия других факторов, интенсифицирующих процесс: катализатор снижает энергию активации процесса
- 6. наличие катализатора не влияет на величину изменения энергии Гиббса химической реакции. рассмотрим одну и ту же
- 7. Следствия: 1. Использование катализатора не может вызвать термодинамически невозможную реакцию (Если ∆G > 40 кДж/моль) 2.
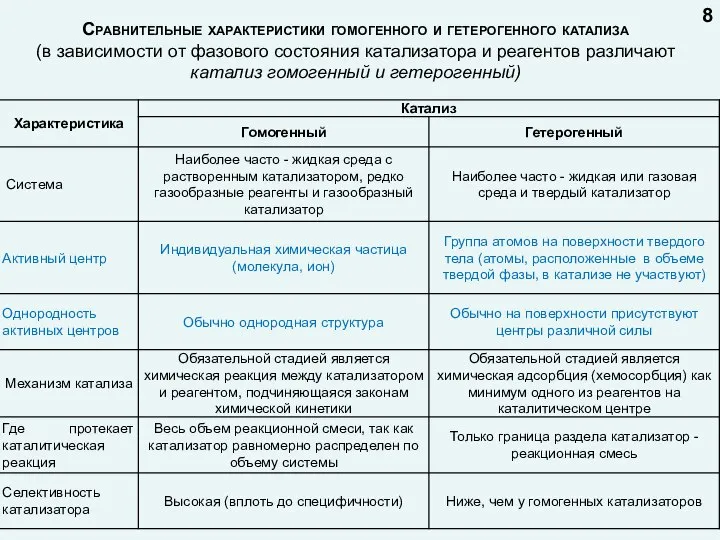
- 8. Сравнительные характеристики гомогенного и гетерогенного катализа (в зависимости от фазового состояния катализатора и реагентов различают катализ
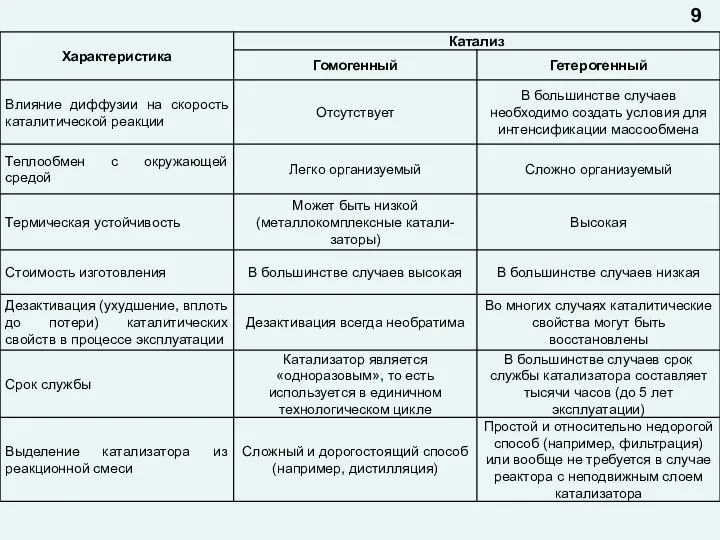
- 9. 9
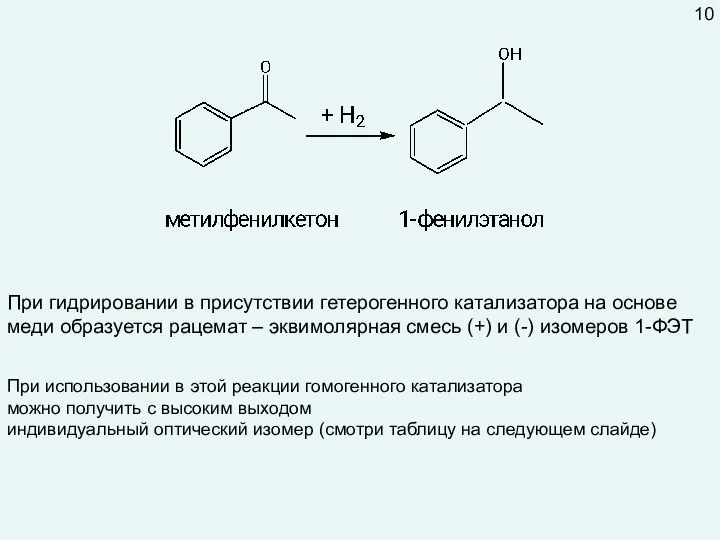
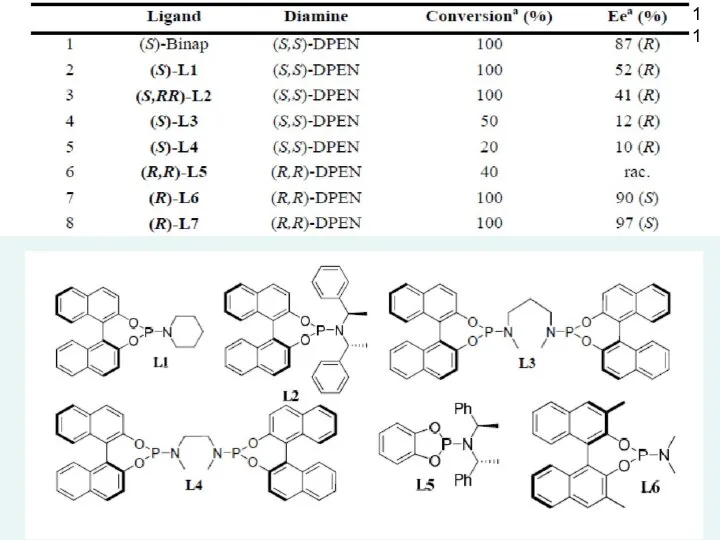
- 10. При гидрировании в присутствии гетерогенного катализатора на основе меди образуется рацемат – эквимолярная смесь (+) и
- 11. 11
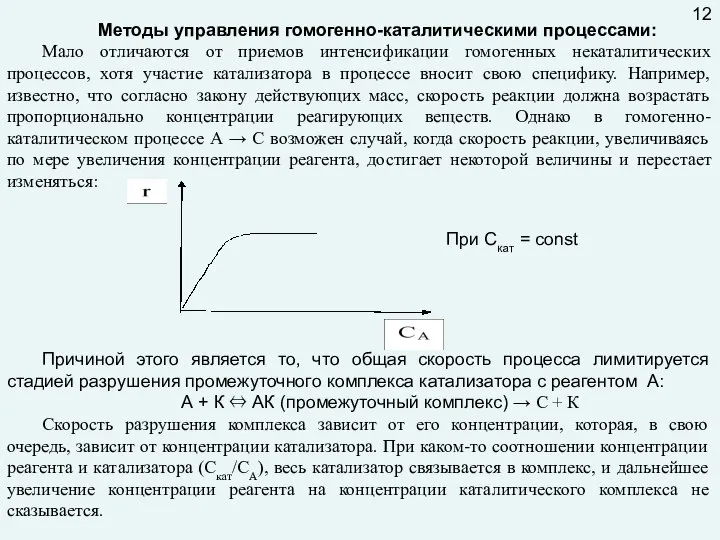
- 12. Методы управления гомогенно-каталитическими процессами: Мало отличаются от приемов интенсификации гомогенных некаталитических процессов, хотя участие катализатора в
- 13. Скелетный никель-алюмо-титановый катализатор активируется обработкой растворами щелочей катализатор жидкофазного гидрирования, например ненасыщенных жирных кислот 13
- 14. 14 КАТАЛИЗАТОР НТК-11 (ТУ-113-03-0209515-66-99) Исходный сплав После выщелачивания
- 15. Цементный медно-никелевый катализатор ГТТ активируется обработкой в атмосфере водорода при температурах ~ 3000С назначение очистка газовых
- 16. Цементный катализатор НТК-10-2ФА (ГИАП, Новомосковск, Тульская область) Содержание, %-мас.: CuO – 48,8 ZnO – 20,2 Al2O3
- 17. Алюмо-никель молибденовый катализатор активируется обработкой сероводородом в восстановительной атмосфере назначение газофазное гидрирование непредельных и гидрогенолиз серусодержащих
- 18. Алюмо-кобальт молибденовый катализатор активируется обработкой сероводородом в восстановительной атмосфере назначение газофазное гидрирование непредельных и гидрогенолиз серусодержащих
- 19. Палладий алюмооксидный катализатор (Pd/гамма-Al2O3) активируется обработкой в атмосфере водорода при повышенной температуре назначение жидкофазное гидрирование непредельных
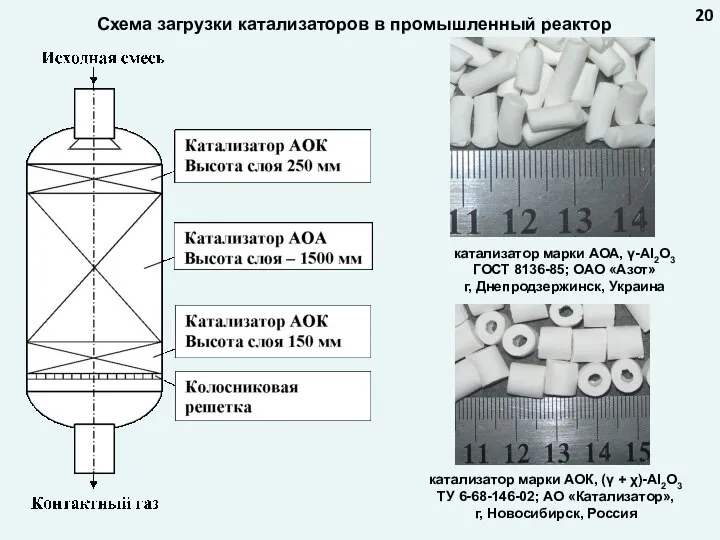
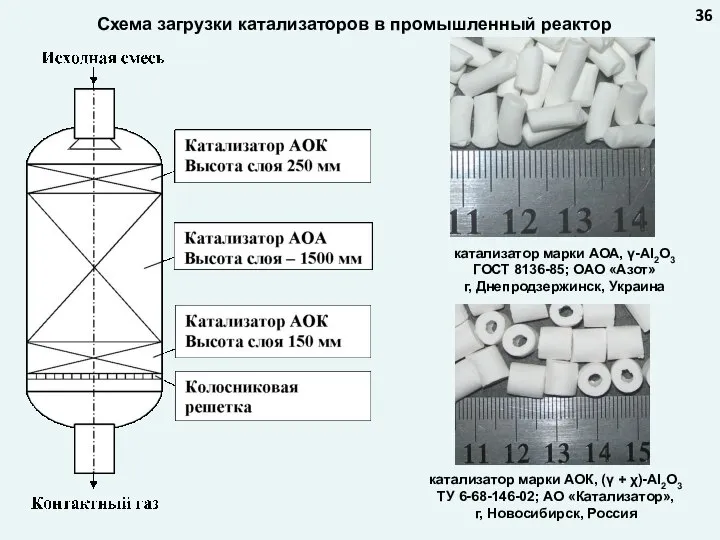
- 20. Схема загрузки катализаторов в промышленный реактор 20 катализатор марки АОА, γ-Al2O3 ГОСТ 8136-85; ОАО «Азот» г,
- 21. Стадии гетерогенно-каталитической реакции А (газ) → B (газ) Выделяем следующие элементарные стадии: 1 – внешняя диффузия
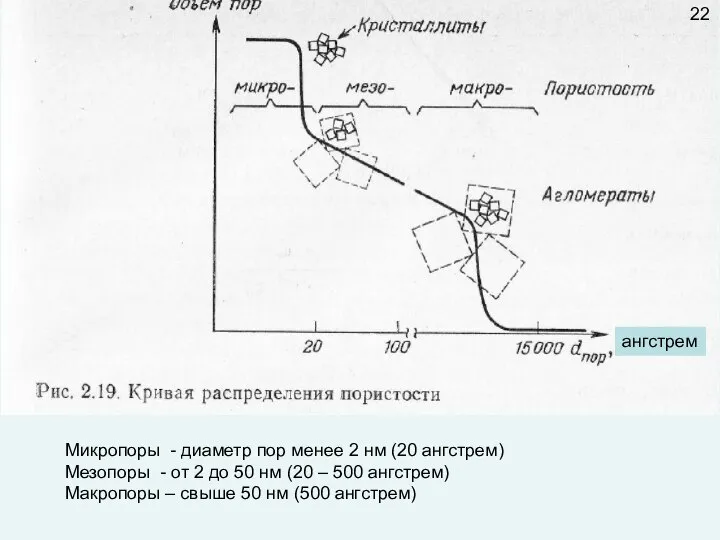
- 22. Микропоры - диаметр пор менее 2 нм (20 ангстрем) Мезопоры - от 2 до 50 нм
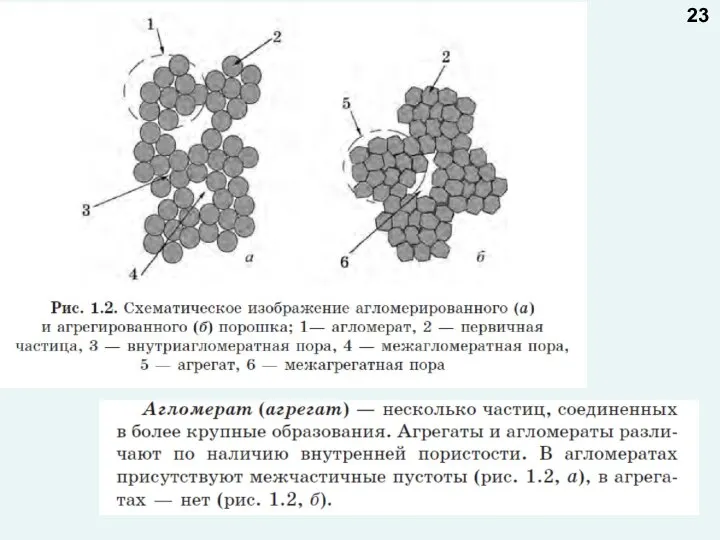
- 23. 23
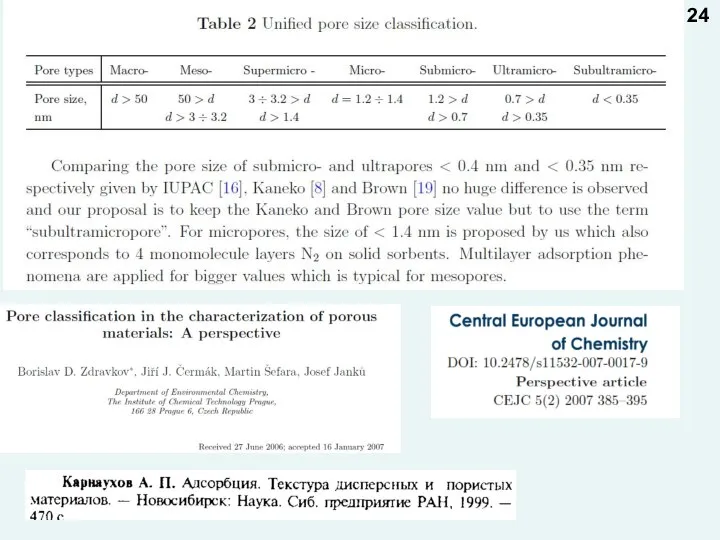
- 24. 24
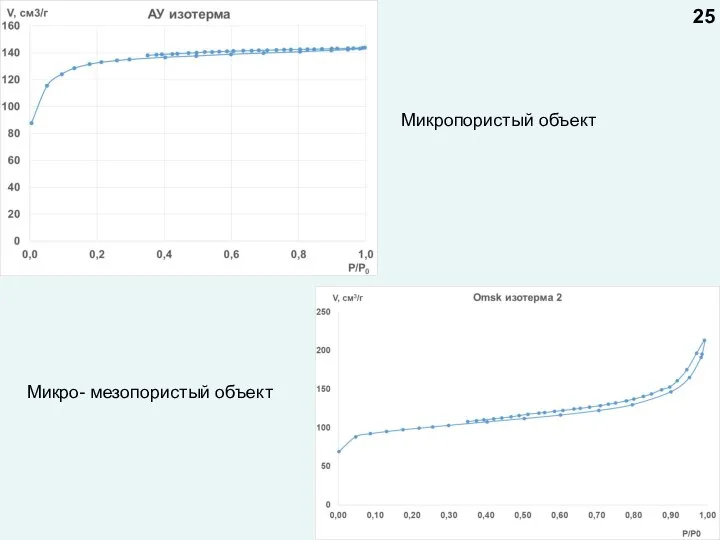
- 25. 25 Микропористый объект Микро- мезопористый объект
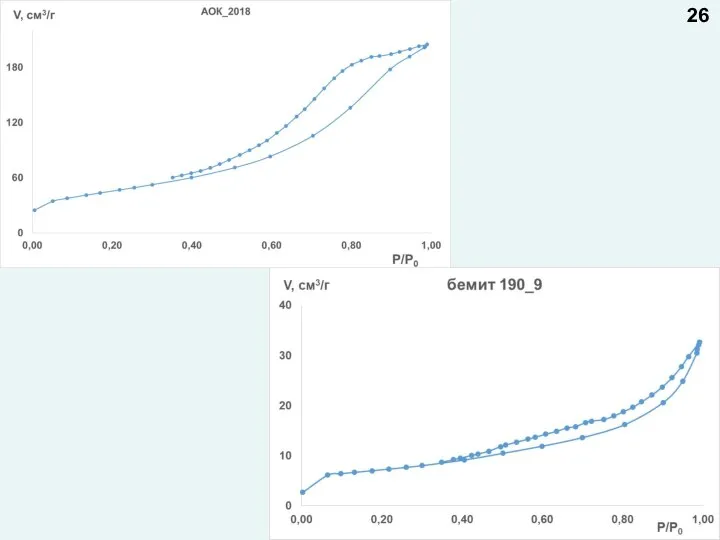
- 26. 26
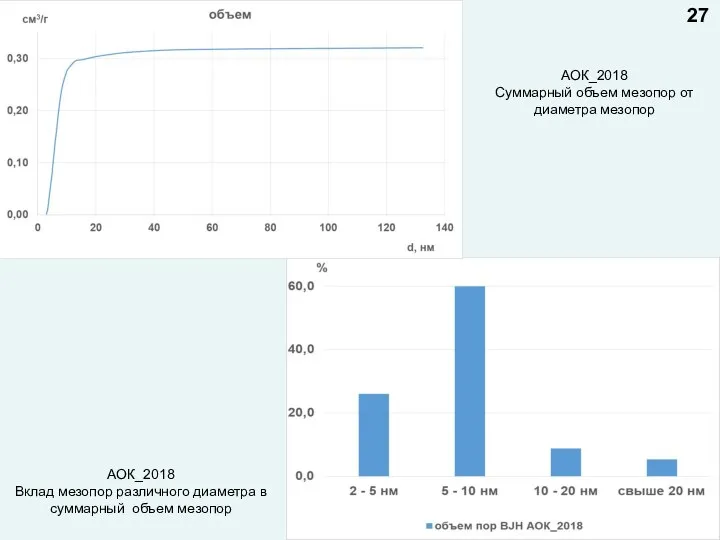
- 27. АОК_2018 Суммарный объем мезопор от диаметра мезопор АОК_2018 Вклад мезопор различного диаметра в суммарный объем мезопор
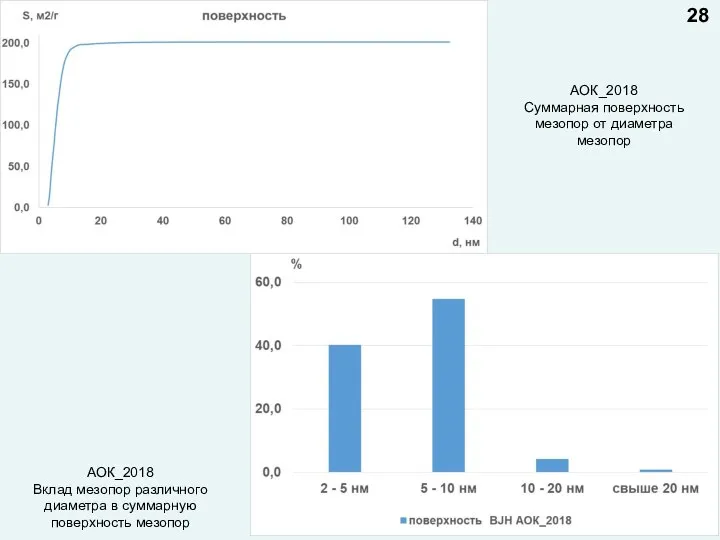
- 28. АОК_2018 Суммарная поверхность мезопор от диаметра мезопор АОК_2018 Вклад мезопор различного диаметра в суммарную поверхность мезопор
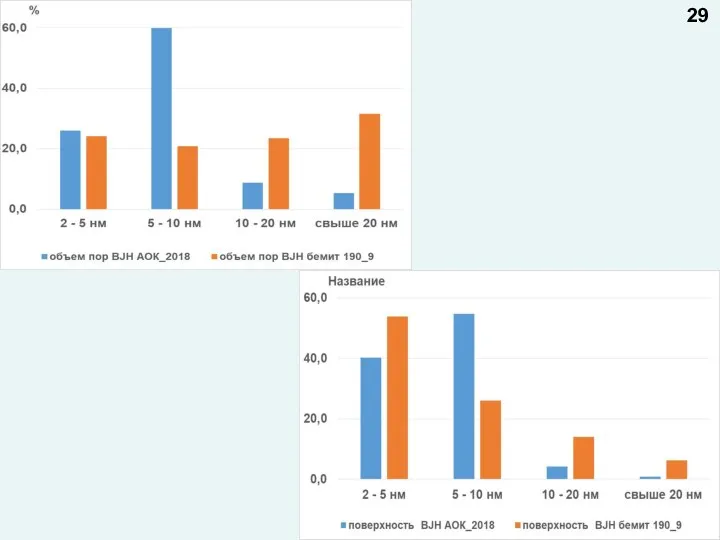
- 29. 29
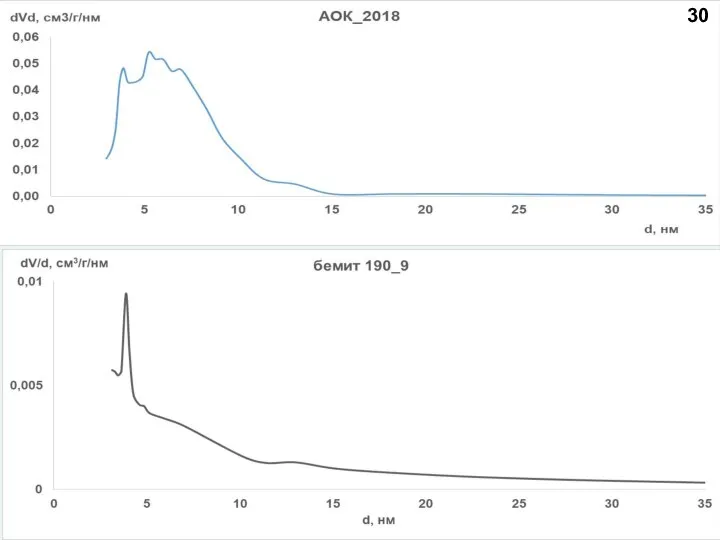
- 30. 30
- 31. 31
- 32. 32
- 33. 33
- 34. 34
- 35. Истинная плотность, г/см3 3,2241 3,3651 Кажущаяся плотность, г/см3 0,8116 1,2811 Общий объем пор, см3/г 0,9220 0,4834
- 36. Схема загрузки катализаторов в промышленный реактор 36 катализатор марки АОА, γ-Al2O3 ГОСТ 8136-85; ОАО «Азот» г,
- 37. 37
- 38. 38
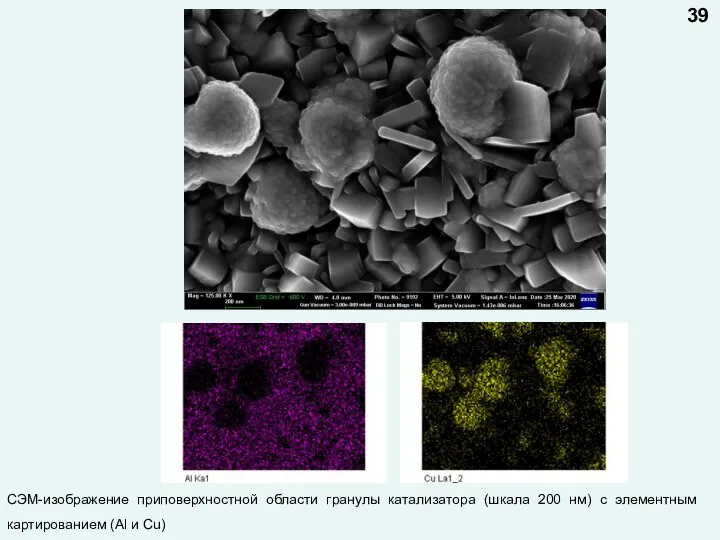
- 39. СЭМ-изображение приповерхностной области гранулы катализатора (шкала 200 нм) c элементным картированием (Al и Cu) 39
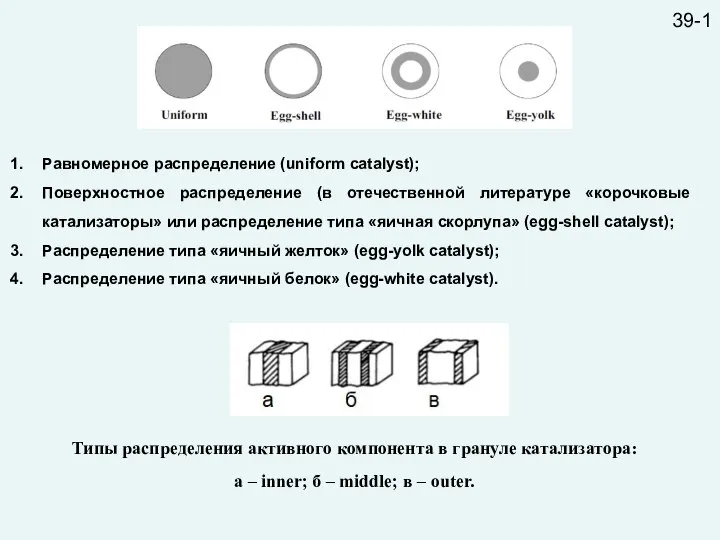
- 40. Равномерное распределение (uniform catalyst); Поверхностное распределение (в отечественной литературе «корочковые катализаторы» или распределение типа «яичная скорлупа»
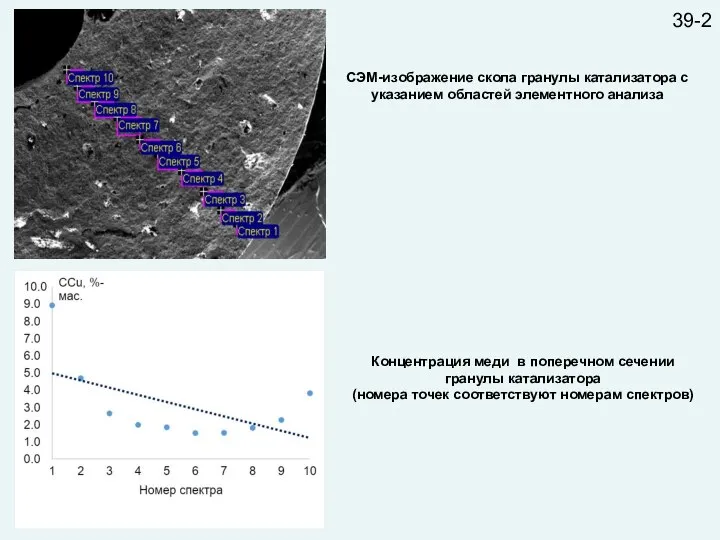
- 41. СЭМ-изображение скола гранулы катализатора с указанием областей элементного анализа Концентрация меди в поперечном сечении гранулы катализатора
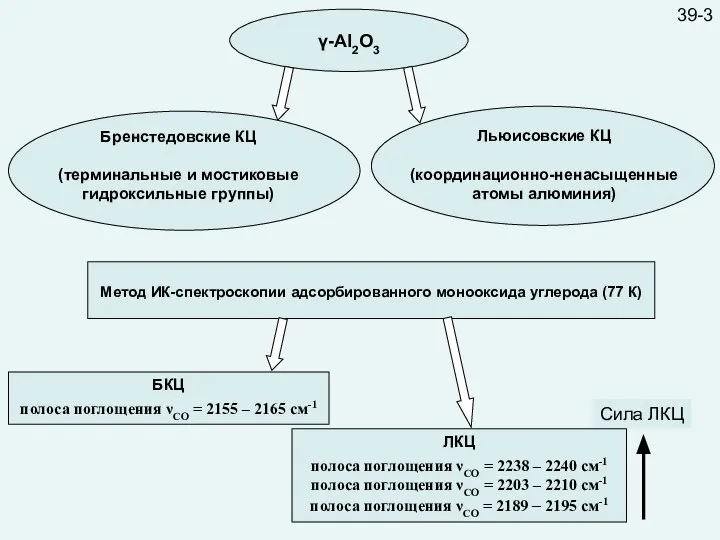
- 42. Сила ЛКЦ 39-3 γ-Al2O3 Метод ИК-спектроскопии адсорбированного монооксида углерода (77 К) БКЦ полоса поглощения νCO =
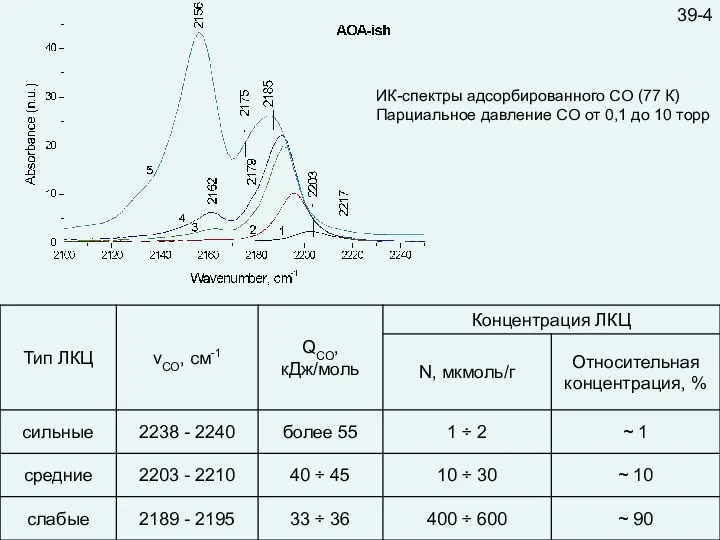
- 43. 39-4 ИК-спектры адсорбированного СО (77 К) Парциальное давление СО от 0,1 до 10 торр
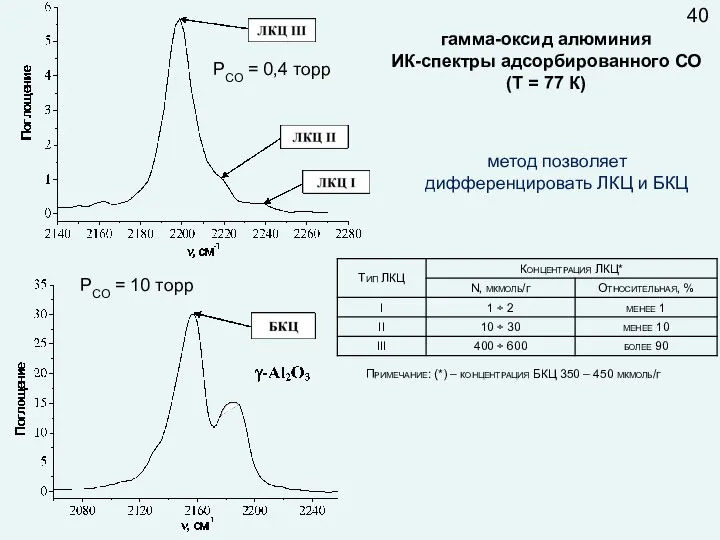
- 44. гамма-оксид алюминия ИК-спектры адсорбированного СО (Т = 77 К) PСО = 0,4 торр PСО = 10
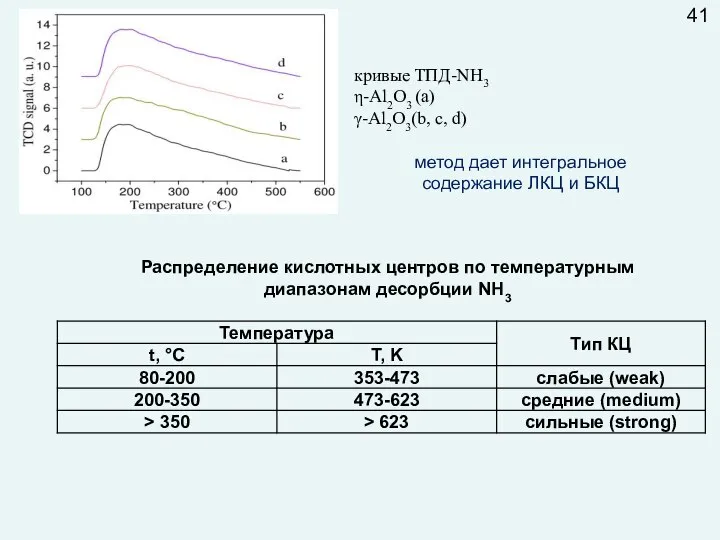
- 45. кривые ТПД-NH3 η-Al2O3 (a) γ-Al2O3(b, c, d) 41 Распределение кислотных центров по температурным диапазонам десорбции NH3
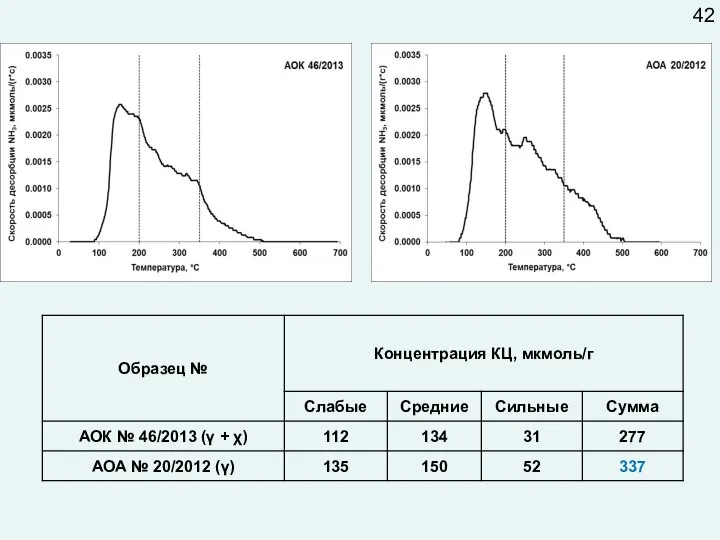
- 46. 42
- 47. 43
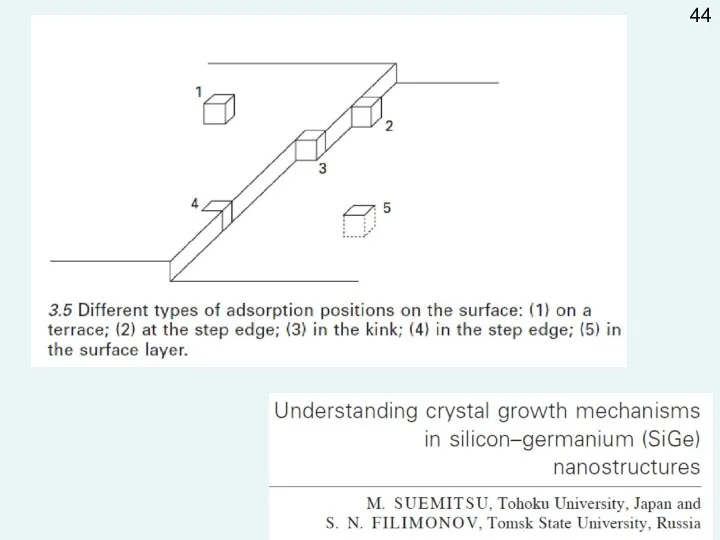
- 48. 44
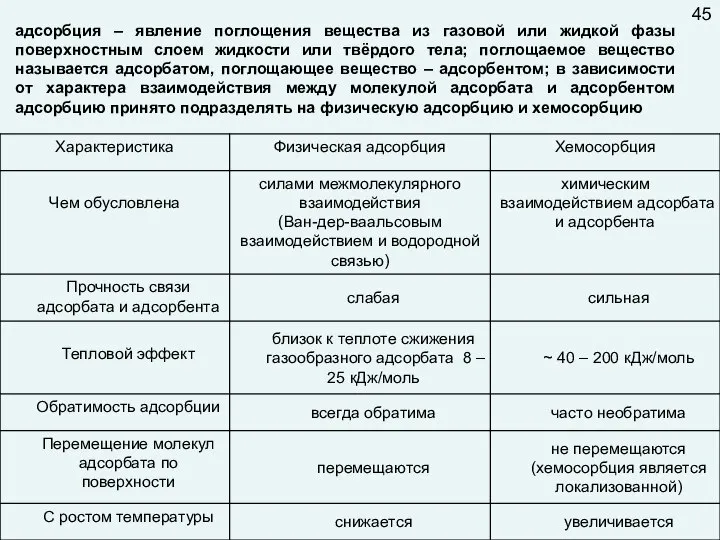
- 49. адсорбция – явление поглощения вещества из газовой или жидкой фазы поверхностным слоем жидкости или твёрдого тела;
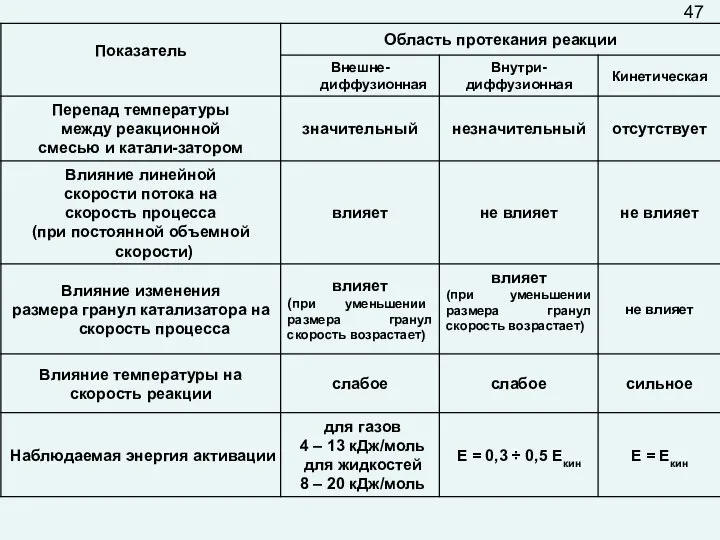
- 50. В зависимости от того, какая из стадий гетерогенно-каталитического процесса является лимитирующей, различают три основные области его
- 51. 47
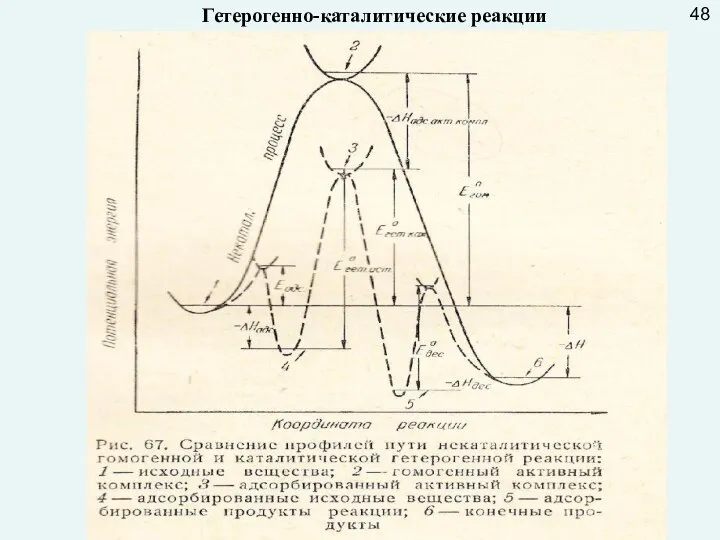
- 52. Гетерогенно-каталитические реакции 48
- 53. Для интенсификации процесса, протекающего во внешнедиффузионной области, используются такие инструменты управления, которые увеличивают скорость массопередачи в
- 55. № 23 КАТАЛИЗАТОР НТК-11 (ТУ-113-03-0209515-66-99) Исходный сплав После выщелачивания
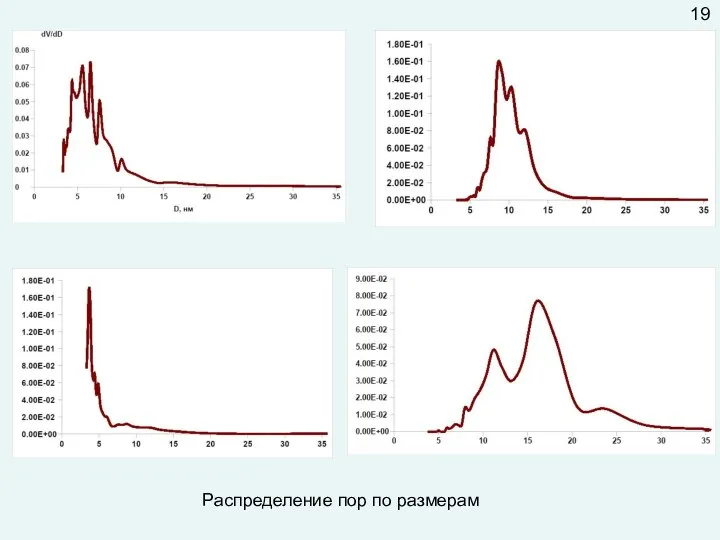
- 62. Распределение пор по размерам 19
- 64. Скачать презентацию




























 Гидролиз солей – частный случай РИО
Гидролиз солей – частный случай РИО Презентация на тему Состав, строение и свойства стекла и хрусталя
Презентация на тему Состав, строение и свойства стекла и хрусталя  Электрохимические процессы
Электрохимические процессы pervonachalnye_svedenia_ob_org_v-kh
pervonachalnye_svedenia_ob_org_v-kh Пятичленные гетероциклы с двумя и более атомами азота
Пятичленные гетероциклы с двумя и более атомами азота Увлекательный мир химии
Увлекательный мир химии Учёные-химики в годы Великой Отечественной войны
Учёные-химики в годы Великой Отечественной войны Углерод
Углерод Основания
Основания Методы получения нафтиридинов (всех изомеров)
Методы получения нафтиридинов (всех изомеров) Составление формул оксидов, оснований, солей
Составление формул оксидов, оснований, солей Химический состав клетки
Химический состав клетки Презентация в 8 классе к уроку по химии на тему__
Презентация в 8 классе к уроку по химии на тему__ Фотохромные биоматериалы. Применение спиропирановых систем в медицине
Фотохромные биоматериалы. Применение спиропирановых систем в медицине Электролитическая диссоциация веществ Реакции ионного обмена и условия их протекания
Электролитическая диссоциация веществ Реакции ионного обмена и условия их протекания Пусть имя Д.И. Менделеева будет нашей путеводной звездой
Пусть имя Д.И. Менделеева будет нашей путеводной звездой Химия в космосе Автор: Гриб Яна ученица 8а класса школа №484. Научный руководитель: Бирюкова Зоя Владимировна.
Химия в космосе Автор: Гриб Яна ученица 8а класса школа №484. Научный руководитель: Бирюкова Зоя Владимировна. Вода как хладагент (R718)
Вода как хладагент (R718) AMFOTERNOST__1
AMFOTERNOST__1 Алкины
Алкины Альдегиды и кетоны (часть 2)
Альдегиды и кетоны (часть 2) Презентация на тему Роль йода в организме
Презентация на тему Роль йода в организме  Перегонка. Вклад алхимиков в органическую химию
Перегонка. Вклад алхимиков в органическую химию Коррозия металлов
Коррозия металлов Электролитическая диссоциация. 9 класс
Электролитическая диссоциация. 9 класс Нефть. Её состав. Термический и каталитический крекинг
Нефть. Её состав. Термический и каталитический крекинг Технологические особенности никеля и никелевых сплавов
Технологические особенности никеля и никелевых сплавов Презентация на тему Бром
Презентация на тему Бром