Содержание
- 2. Цель урока обобщить и систематизировать знания о видах химической связи и их классификации как о важнейшем
- 3. План изучения темы урока Понятие «химическая связь». Ионная химическая связь: механизм образования; характеристики связи; ионная кристаллическая
- 4. Что такое химическая связь?
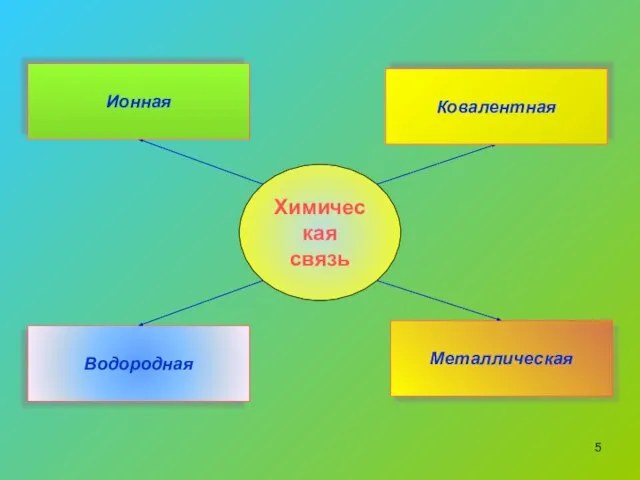
- 5. Химическая связь Водородная Металлическая Ковалентная Ионная
- 6. Электроотрицательность - способность атомов одних химических элементов притягивать электроны в соединениях от атомов других химических элементов
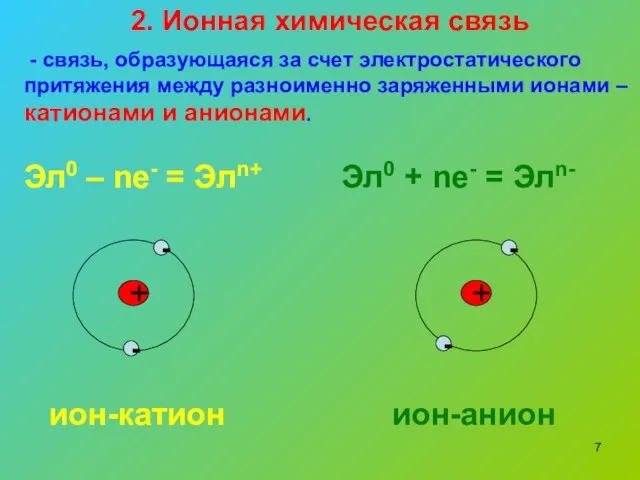
- 7. 2. Ионная химическая связь - связь, образующаяся за счет электростатического притяжения между разноименно заряженными ионами –
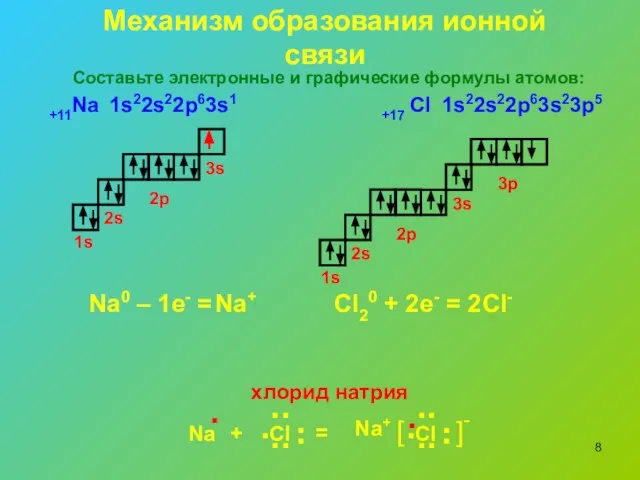
- 8. Механизм образования ионной связи 1s22s22p63s1 1s 2s 3s 2p 1s 2s 3s 2p 3p 1s22s22p63s23p5 Na0
- 9. Запомни!!! полного перехода электронов при образовании ионной химической связи не происходит. Об этом свидетельствуют величины эффективных
- 10. Электроотрицательность - способность атомов одних химических элементов притягивать электроны в соединениях от атомов других химических элементов
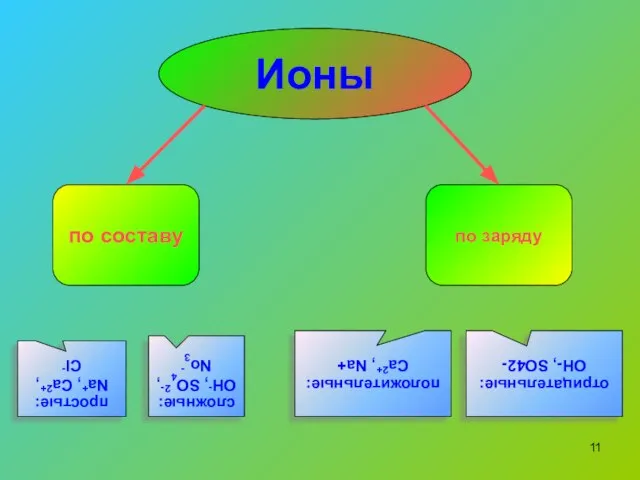
- 11. по составу по заряду простые: Na+, Ca2+, Cl- сложные: OH-, SO42-, No3- положительные: Ca2+, Na+ Ионы
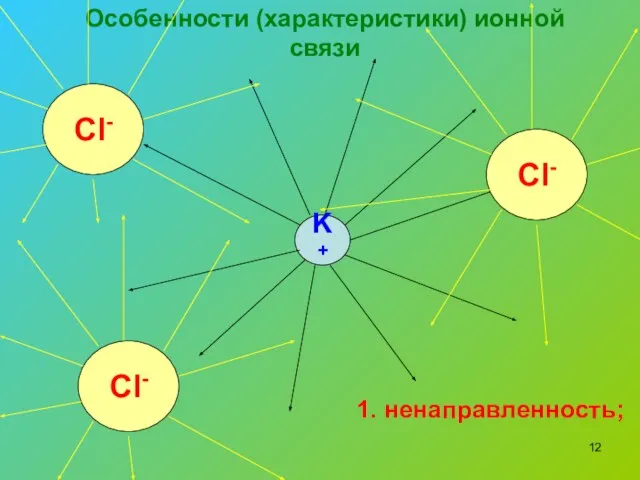
- 12. Особенности (характеристики) ионной связи K+ Cl- Cl- Cl- 1. ненаправленность;
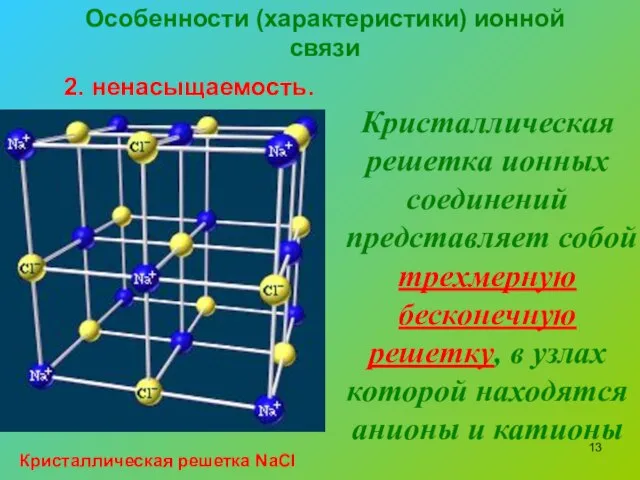
- 13. Особенности (характеристики) ионной связи 2. ненасыщаемость. Кристаллическая решетка ионных соединений представляет собой трехмерную бесконечную решетку, в
- 14. Домашнее задание §6 (стр. 44-46), упр. 4 на стр. 56, распишите механизм образования ионной связи в
- 16. Скачать презентацию







 Презентация на тему Физические и химические явления 8 класс
Презентация на тему Физические и химические явления 8 класс  Пятичленные гетероциклы с двумя и более атомами азота
Пятичленные гетероциклы с двумя и более атомами азота Химические свойства металлов. Электрохимический ряд напряжения металлов
Химические свойства металлов. Электрохимический ряд напряжения металлов Фізика гірських порід і процесів. Хімічні зв'язки в мінералах. Іонний зв'язок
Фізика гірських порід і процесів. Хімічні зв'язки в мінералах. Іонний зв'язок Презентация на тему Нанохимия
Презентация на тему Нанохимия  Презентация на тему Альдегиды (10 класс)
Презентация на тему Альдегиды (10 класс)  Классификация методов аналитической химии
Классификация методов аналитической химии Химические свойства алканов. Алканы
Химические свойства алканов. Алканы Химическае препараты
Химическае препараты Пидорасня
Пидорасня Введение в органическую химию. Классификация органических соединений
Введение в органическую химию. Классификация органических соединений Агрегатные состояния вещества
Агрегатные состояния вещества Стелс-материалы
Стелс-материалы Химическая связь
Химическая связь строение атома обуч-контр прогр
строение атома обуч-контр прогр Предельные углеводороды
Предельные углеводороды Особенные свойства муравьиной кислоты
Особенные свойства муравьиной кислоты Спирты
Спирты Капрон
Капрон Реакции
Реакции Неметаллы. Общая характеристика
Неметаллы. Общая характеристика Химия и повседневная жизнь человека. Почистим изделия из металлов
Химия и повседневная жизнь человека. Почистим изделия из металлов Презентация на тему Водород
Презентация на тему Водород  Пятая группа элементов
Пятая группа элементов Метанол. Краткая характеристика
Метанол. Краткая характеристика Основания. Классификация
Основания. Классификация Применение муравьиного спирта
Применение муравьиного спирта VVEDENIE_V_OGRANIChESKUYu_KhIMIYu
VVEDENIE_V_OGRANIChESKUYu_KhIMIYu