Содержание
- 2. Дисперные системы Смеси веществ по степени дисперсности (дисперсность — характеристика размеров частиц данного вещества) условно разделяют
- 3. Виды дисперсных систем Суспензия — взвесь частиц одного или нескольких твердых веществ в жидкой среде. Эмульсия
- 4. Виды дисперсных систем Коллоидные растворы (или золи) — микрогетерогенные, метастабильные системы с жидкой средой, содержащей очень
- 5. Качественный состав растворов Растворителем считают то вещество, агрегатное состояние которого не изменяется при образовании раствора Растворенное
- 6. Количественный состав растворов Соотношение количества растворенного вещества и растворителя количественно определяет концентрация раствора. В неорганической химии
- 7. Концентрация раствора Концентрация в химии – это молярность раствора Единица измерения молярной концентрации сB2 – моль/л.
- 8. Концентрация раствора Моляльность растворенного вещества В (обозначение cm) определяется как отношение количества вещества В (nB, моль)
- 9. Растворимость Растворимость – это способность вещества растворяться в данном растворителе при заданной температуре. Количественно растворимость измеряется
- 10. Насыщенный раствор Насыщенным (при данной температуре) называют раствор, который находится в равновесии с растворяемым веществом. Устанавливается
- 11. Ненасыщенный раствор Ненасыщенным называют раствор, концентрация которого меньше, чем у насыщенного (при данной температуре) раствора.
- 12. Пересыщенный раствор Пересыщенный раствор содержит растворенного вещества больше, чем требуется для насыщения при данной температуре.
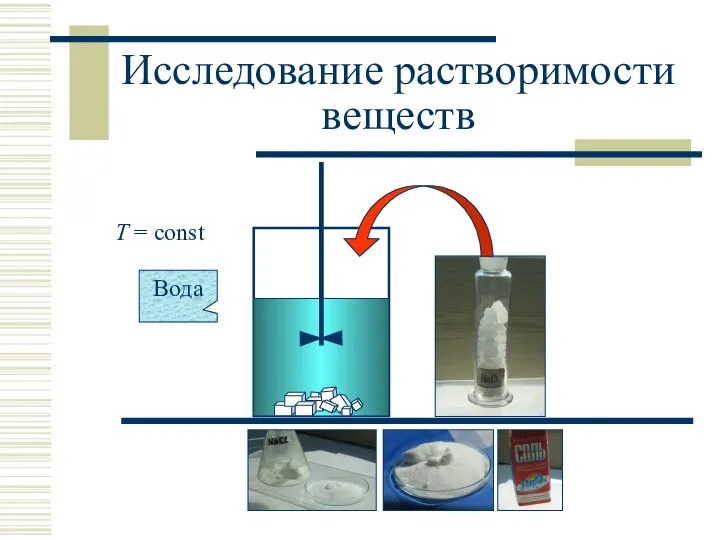
- 13. Исследование растворимости веществ Эксперимент: растворение кристаллического вещества (хлорид натрия) в жидком растворителе (вода)
- 14. T = const Вода Исследование растворимости веществ
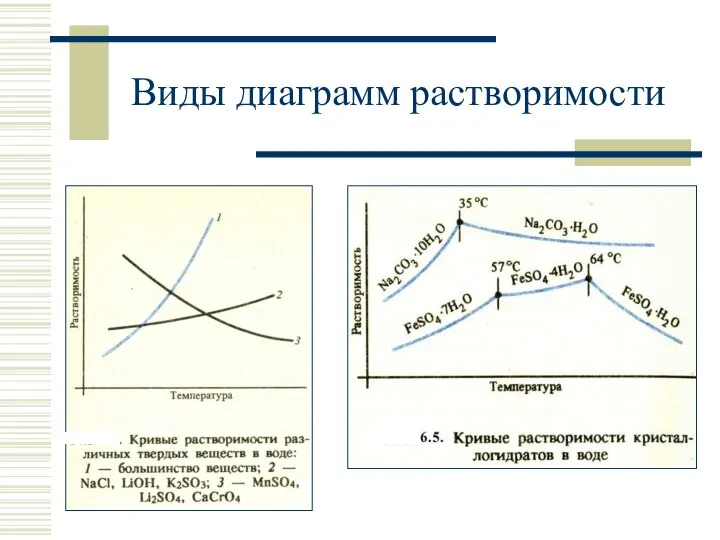
- 15. Диаграмма растворимости График зависимости растворимости от температуры – диаграмма (политерма) растворимости
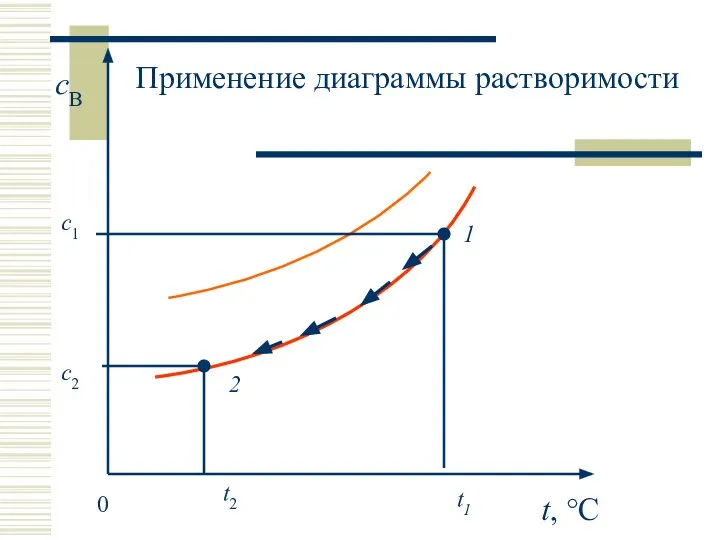
- 16. Применение диаграммы растворимости Эксперимент: Получение насыщенного раствора из ненасыщенного. Охлаждение насыщенного раствора Диаграмма растворимости
- 17. t, °C cB 0 t1 1 2 с1 с2 Применение диаграммы растворимости t2
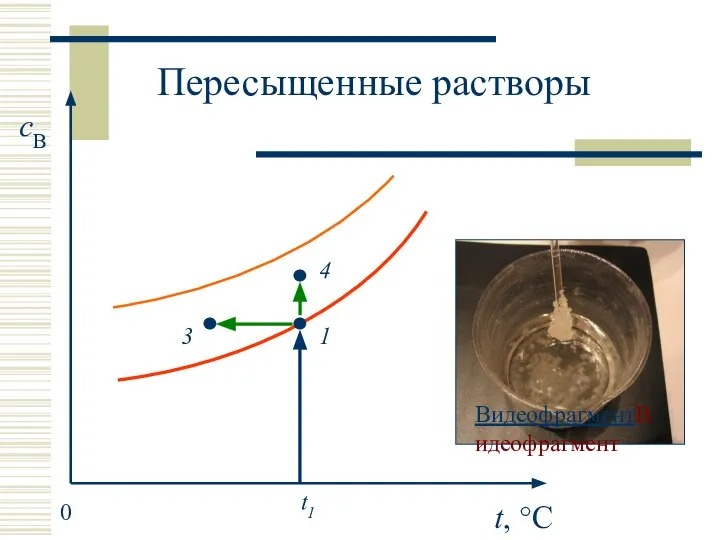
- 18. Пересыщенные растворы Эксперимент: получение пересыщенных растворов из насыщенных Диаграмма растворимости
- 19. t, °C cB 0 t1 1 3 4 Пересыщенные растворы ВидеофрагментВидеофрагмент
- 20. Виды диаграмм растворимости
- 21. Растворимость газов Взаимная растворимость газов неограниченна. Растворимость газа в жидкости зависит от природы газа, растворителя, температуры
- 22. Растворимость газов в воде Кислород O2: 4,89 0°C 3,10 20°C 1,72 100°C Азот N2: 2,35 0°C
- 23. Растворимость газов Ж1 + Г2: сольватация H2O(ж) ⮀ (H2O)х при 25 °С х ≈ 4 Энтальпия
- 24. Взаимная растворимость жидкостей Неограниченная взаимная растворимость (вода и этанол, вода и серная кислота, вода и ацетон
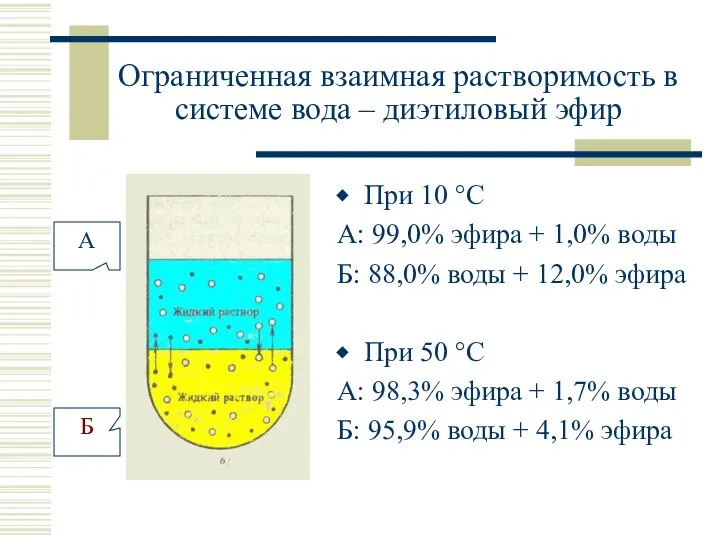
- 25. Ограниченная взаимная растворимость в системе вода – диэтиловый эфир При 10 °С А: 99,0% эфира +
- 26. Экстракция иода керосином из водного раствора
- 27. Растворимость твердых веществ в жидкостях (Ж1 + Т2) Для смешения: ΔGM = ΔHM - TΔSM Энтропийный
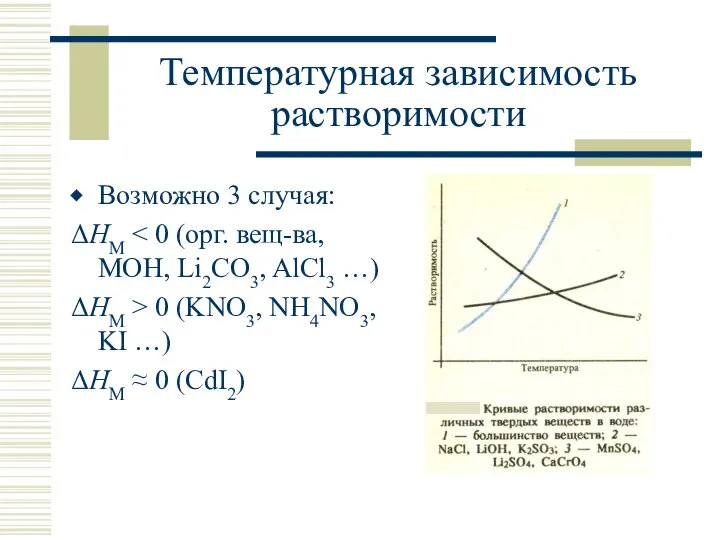
- 28. Температурная зависимость растворимости Возможно 3 случая: ΔHM ΔHM > 0 (KNO3, NH4NO3, KI …) ΔHM ≈
- 30. Скачать презентацию




















 Чистые вещества и смеси. Классификация веществ. Оксиды
Чистые вещества и смеси. Классификация веществ. Оксиды История развития органической химии
История развития органической химии Радиоакивные металлы
Радиоакивные металлы Химические свойства кислот
Химические свойства кислот Диаграмма состояния BaO-Al2O3-SiO2
Диаграмма состояния BaO-Al2O3-SiO2 Простые эфиры и перекиси
Простые эфиры и перекиси Химическое ассорти
Химическое ассорти Якісні реакції органічних речовин
Якісні реакції органічних речовин Цветные опыты
Цветные опыты Фарфор и фаянс
Фарфор и фаянс Температурная зависимость времени спин-решеточной релаксации протонов в H2La2Ti3O10
Температурная зависимость времени спин-решеточной релаксации протонов в H2La2Ti3O10 Химическое равновесие. Экзаменационные вопросы
Химическое равновесие. Экзаменационные вопросы Опасность вещества поливинилхлорида
Опасность вещества поливинилхлорида ИКТ как средство реализации проблемного обучения на уроках химии
ИКТ как средство реализации проблемного обучения на уроках химии ЦОКО 2 курс. Химия
ЦОКО 2 курс. Химия Липиды. Состав липидов
Липиды. Состав липидов Никель
Никель Кислотность почв с.Берёзовка МОУ «СОШ с.Берёзовка» Колесников Иван, 9 класс Пряхина Виктория, 8 класс
Кислотность почв с.Берёзовка МОУ «СОШ с.Берёзовка» Колесников Иван, 9 класс Пряхина Виктория, 8 класс Химические свойства оксидов
Химические свойства оксидов Природный газ, состав применение в качестве топлива
Природный газ, состав применение в качестве топлива Типы химических реакций. Что такое химическая реакция?
Типы химических реакций. Что такое химическая реакция? Углеводороды: изомерия
Углеводороды: изомерия Генетические ряды неорганических веществ
Генетические ряды неорганических веществ Разбор задач
Разбор задач Периодическая система
Периодическая система Оксиды и их свойства
Оксиды и их свойства Презентация на тему Простые вещества - неметаллы
Презентация на тему Простые вещества - неметаллы  Обмен жиров в организме млекопитающего
Обмен жиров в организме млекопитающего