Содержание
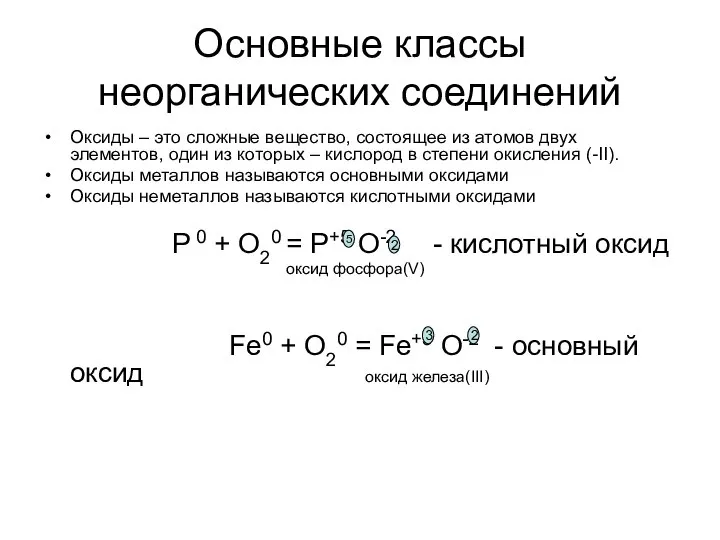
- 2. Основные классы неорганических соединений Оксиды – это сложные вещество, состоящее из атомов двух элементов, один из
- 3. ГИДРОКСИДЫ При взаимодействии оксида металла с водой образуется гидроксид – основание, в формуле которого на первом
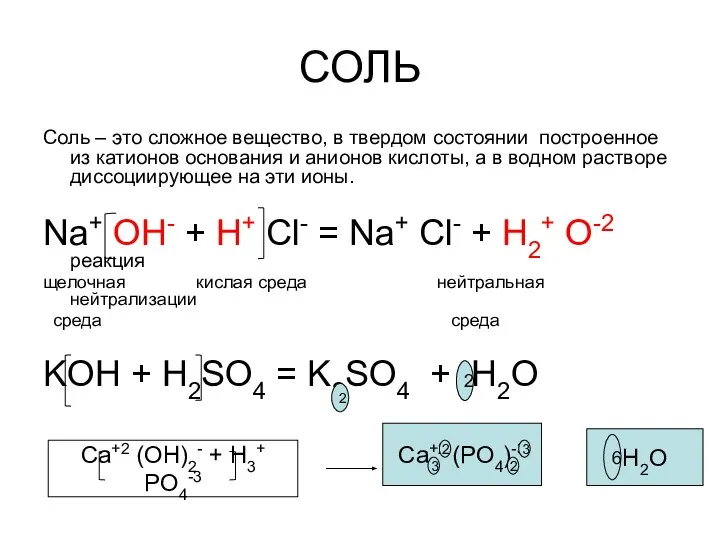
- 4. СОЛЬ Соль – это сложное вещество, в твердом состоянии построенное из катионов основания и анионов кислоты,
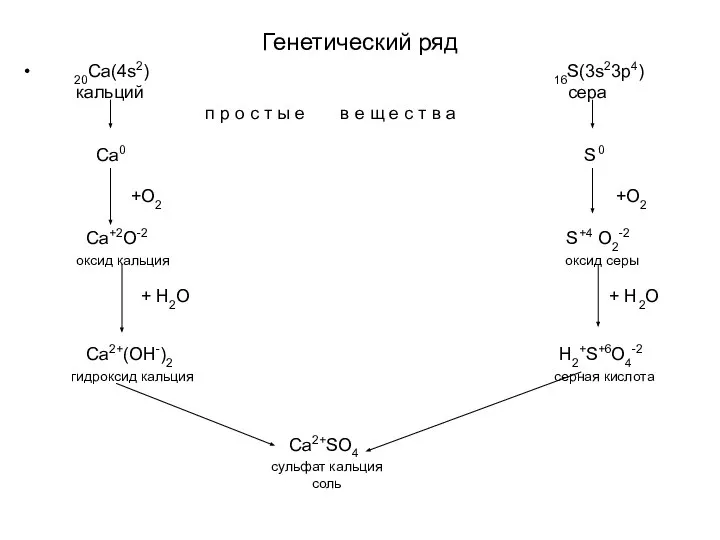
- 5. Генетический ряд 20Са(4s2) 16S(3s23p4) кальций сера п р о с т ы е в е щ
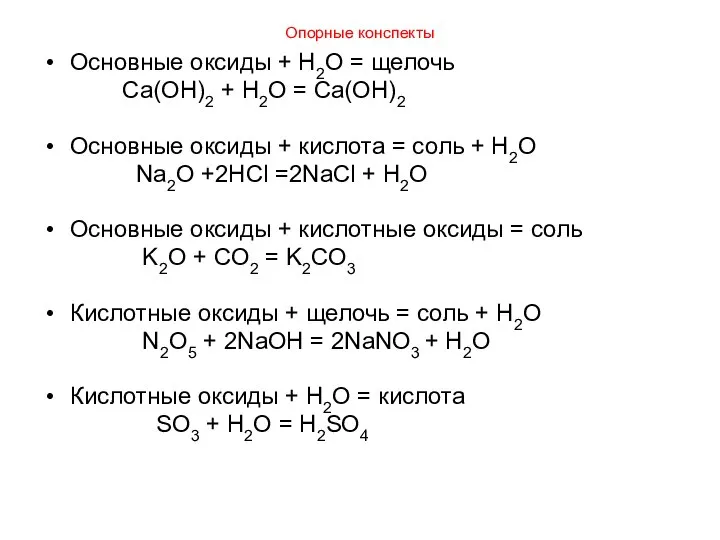
- 6. Опорные конспекты Основные оксиды + H2O = щелочь Ca(OH)2 + H2O = Ca(OH)2 Основные оксиды +
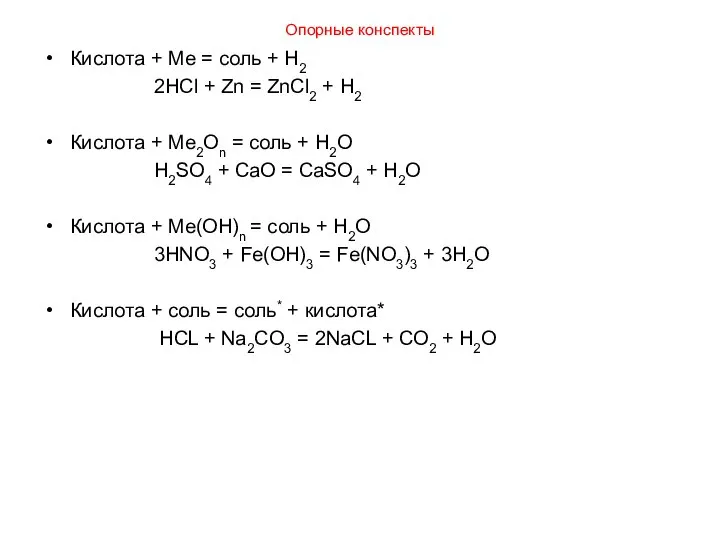
- 7. Опорные конспекты Кислота + Ме = соль + H2 2HCl + Zn = ZnCl2 + H2
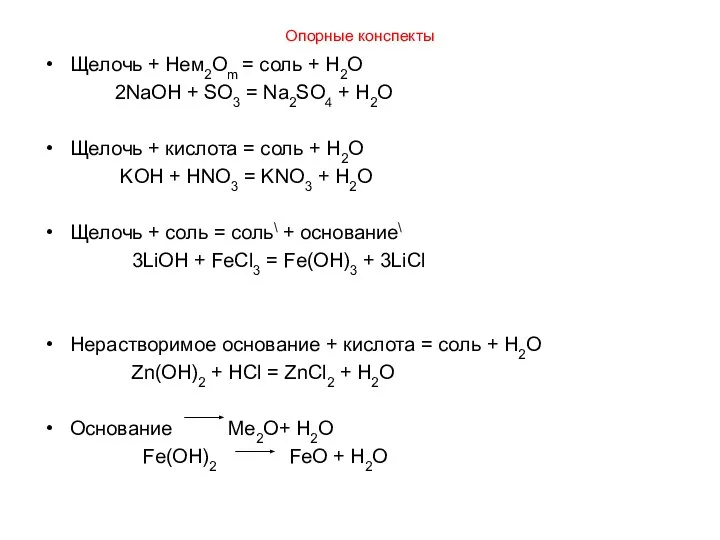
- 8. Опорные конспекты Щелочь + Нем2Оm = соль + H2O 2NaOH + SO3 = Na2SO4 + H2O
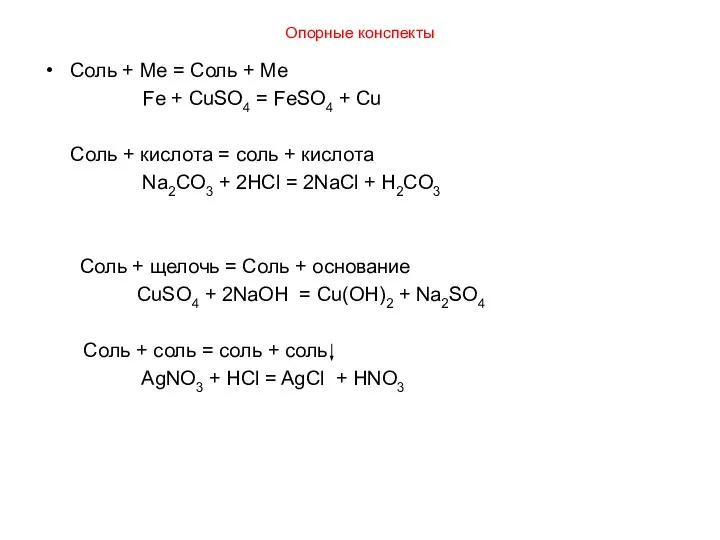
- 9. Опорные конспекты Соль + Me = Соль + Me Fe + CuSO4 = FeSO4 + Cu
- 10. Опорные конспекты Me + нем = бинарное соединение ( соль, оксид) 4Al + 3O2 = 2Al2O3
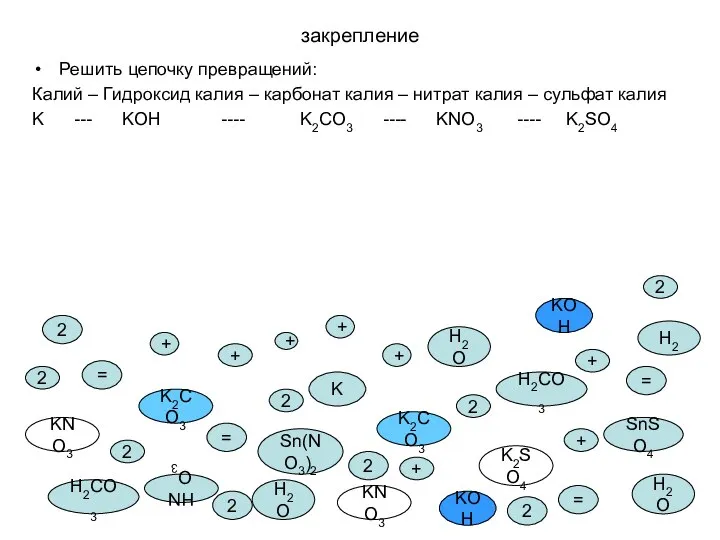
- 11. закрепление Решить цепочку превращений: Калий – Гидроксид калия – карбонат калия – нитрат калия – сульфат
- 13. Скачать презентацию


 Классификация органических соединений и реакций. Изомерия. Лекция 2
Классификация органических соединений и реакций. Изомерия. Лекция 2 Проектная работа Кристаллизация
Проектная работа Кристаллизация Присоединение аммиака и аминов
Присоединение аммиака и аминов Основы химической кинетики
Основы химической кинетики Мыльная история
Мыльная история Общая характеристика аргона
Общая характеристика аргона Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Красители vs пигменты
Красители vs пигменты Химическая связь. Лекция №3
Химическая связь. Лекция №3 Химические равновесия в растворах. Лекция 2. Часть 1
Химические равновесия в растворах. Лекция 2. Часть 1 Потенциометрический анализ, титрование
Потенциометрический анализ, титрование Сложные реакции
Сложные реакции Основания. Растворимые (гидроксиды щелочных и щелочноземельных металлов). Нерастворимые
Основания. Растворимые (гидроксиды щелочных и щелочноземельных металлов). Нерастворимые Презентация на тему Арены (10 класс)
Презентация на тему Арены (10 класс)  Презентация на тему Химия и здоровье человека (10 класс)
Презентация на тему Химия и здоровье человека (10 класс)  Шаблон для презентации по химии
Шаблон для презентации по химии Презентация на тему Все о спиртах
Презентация на тему Все о спиртах  Альдегиды. Состав. Строение. Свойства. Применение
Альдегиды. Состав. Строение. Свойства. Применение Ортофосфорная кислота
Ортофосфорная кислота Степень окисления
Степень окисления Степень окисления. Бинарные соединения
Степень окисления. Бинарные соединения Валентность. Нахождение химической формулы вещества по валентности
Валентность. Нахождение химической формулы вещества по валентности Соли
Соли Vzácne plyny
Vzácne plyny Полезные ископаемые
Полезные ископаемые Терпеноиды. Эфирные масла
Терпеноиды. Эфирные масла Введение в медицинскую химию: от молекулы к лекарству
Введение в медицинскую химию: от молекулы к лекарству Күкірт қышқылын алудың контакт әдісі
Күкірт қышқылын алудың контакт әдісі