Содержание
- 2. Назначение презентации Презентация предназначена для использования в качестве наглядного материала при изучении темы «Кислоты» на уроках
- 3. Цель урока: познакомиться с классификациями и общими химическими свойствами кислот.
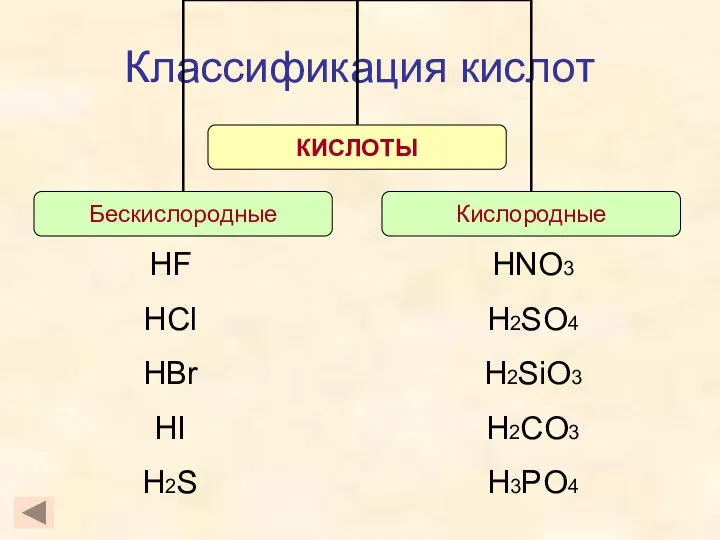
- 4. Классификация кислот HF HCl HBr HI H2S HNO3 H2SO4 H2SiO3 H2CO3 H3PO4
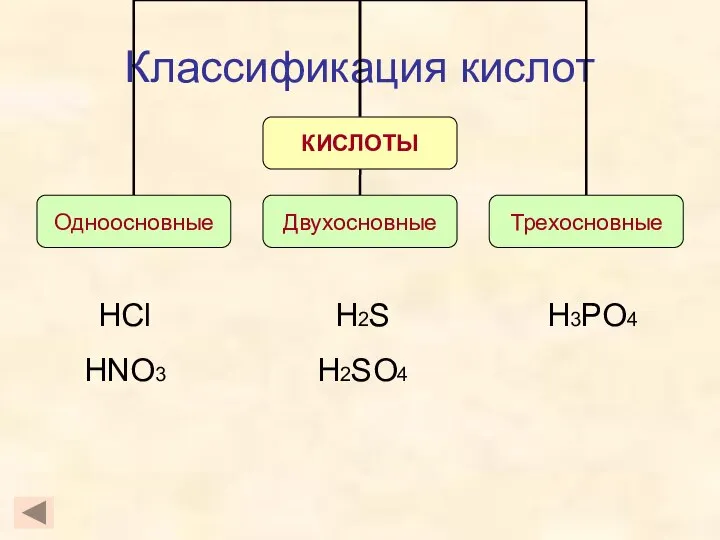
- 5. Классификация кислот HCl HNO3 H3PO4 H2S H2SO4
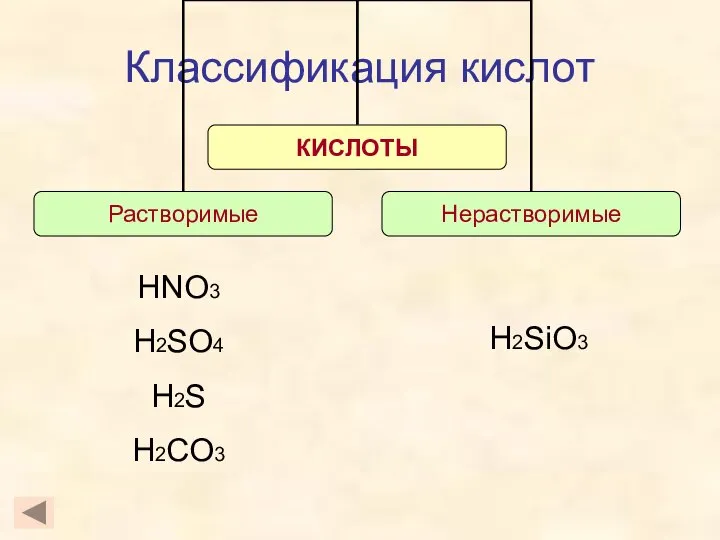
- 6. Классификация кислот H2SiO3 HNO3 H2SO4 H2S H2CO3
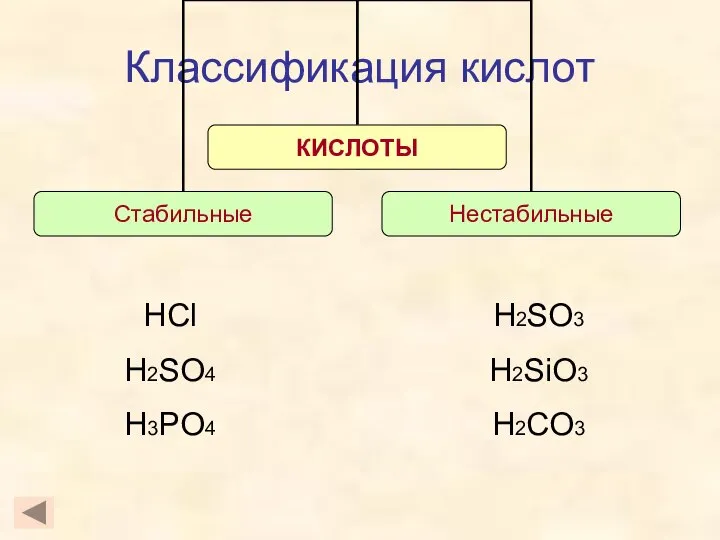
- 7. Классификация кислот HCl H2SO4 H3PO4 H2SO3 H2SiO3 H2CO3
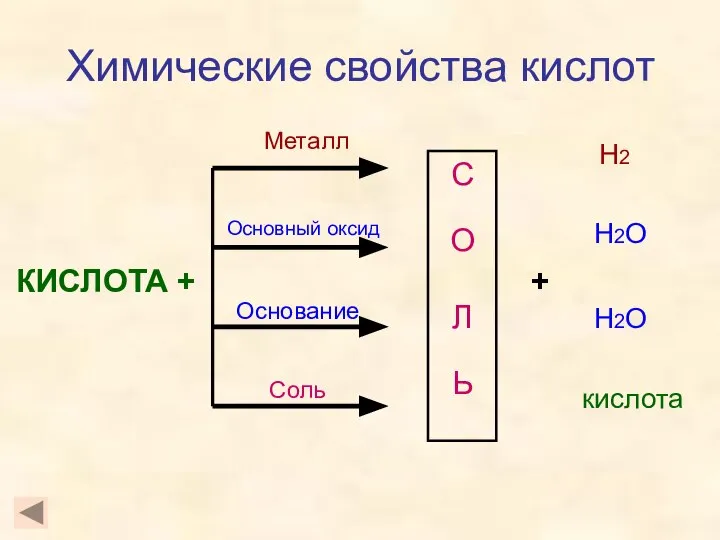
- 8. Химические свойства кислот КИСЛОТА + С О Л Ь Металл Основный оксид Основание Соль + Н2
- 9. Химические свойства кислот Кислота + металл = соль + водород Mg + 2 HCl = MgCl2
- 10. Химические свойства кислот Кислота + основный оксид = соль + вода СuO + H2SO4 = CuSO4
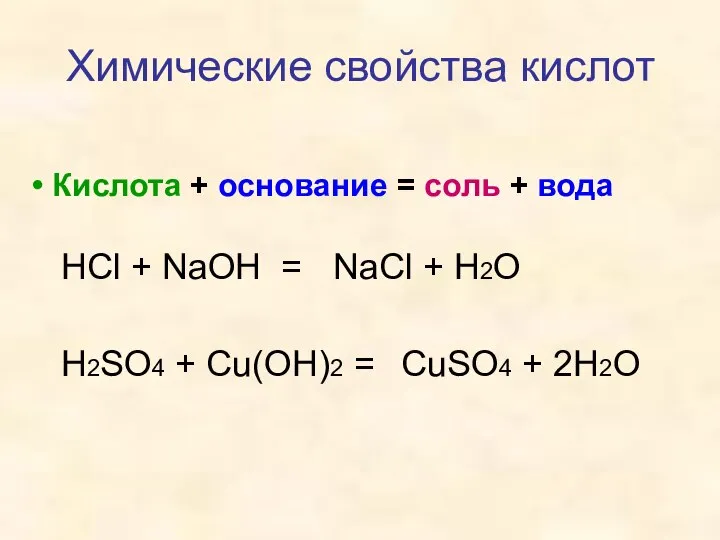
- 11. Кислота + основание = соль + вода Химические свойства кислот HCl + NaOH = H2SO4 +
- 12. Химические свойства кислот Кислота 1 + соль 1 = соль 2 + Кислота 2 Условия реакции:
- 13. Составьте возможные уравнения реакций взаимодействия перечисленных веществ с раствором серной кислоты.
- 15. Скачать презентацию






 Основания
Основания alkany
alkany Фосфаттардағы байланыс теориясы
Фосфаттардағы байланыс теориясы Методы повышения надежности. Резервирование сложных ХТС
Методы повышения надежности. Резервирование сложных ХТС металлы
металлы Аналитическая химия (ЛЕКЦИЯ 1)
Аналитическая химия (ЛЕКЦИЯ 1) История открытия и изучения каркасных фосфатов структурных типов коснарита и лангбейнита
История открытия и изучения каркасных фосфатов структурных типов коснарита и лангбейнита Презентация на тему Углеводороды (10 класс)
Презентация на тему Углеводороды (10 класс)  Характеристика химического элемента по его положению в периодической системе элементов Д.И. Менделеева
Характеристика химического элемента по его положению в периодической системе элементов Д.И. Менделеева Липиды. Омыляемые липиды. Рубежный контроль №2
Липиды. Омыляемые липиды. Рубежный контроль №2 Ионообменная хроматография в разделении белков
Ионообменная хроматография в разделении белков Ұнтақтар - дәрілік түр ретінде
Ұнтақтар - дәрілік түр ретінде Интересные свойства пластика
Интересные свойства пластика Вода-растворитель. Растворы
Вода-растворитель. Растворы Презентация на тему Коррозия металлов (11 класс)
Презентация на тему Коррозия металлов (11 класс)  Химическое вещество золото
Химическое вещество золото ОВР химияПрезентация
ОВР химияПрезентация Презентация на тему Золото
Презентация на тему Золото  Нитраты
Нитраты Оксиды азота
Оксиды азота Тест- тренажер по теме: Основные классы неорганических веществ Оксиды
Тест- тренажер по теме: Основные классы неорганических веществ Оксиды Органическая химия. Химические свойства и типы реакций. (9 класс)
Органическая химия. Химические свойства и типы реакций. (9 класс) Тестирование по химии
Тестирование по химии Лекции_ ОБМЕН ЛИПИДОВ
Лекции_ ОБМЕН ЛИПИДОВ Способы защиты химического оборудования от коррозии
Способы защиты химического оборудования от коррозии Циклоалканы. Физические свойства
Циклоалканы. Физические свойства Задания по химии
Задания по химии Алюминий
Алюминий