Содержание
- 2. Простые эфиры – соединения (производные спиртов и фенолов), содержащие два углеводородных радикала, соединенных с атомом кислорода,
- 3. Классификация Различают: Простые эфиры, содержащие связь Сsp3-O Диалкиловые и дициклоалкиловые эфиры R-O-R¢. СН3СН2ОСН2СН3 диэтиловый эфир (этоксиэтан)
- 4. Изомерия Для простых эфиров характерны все виды структурной и про- странственной изомерии. Изомерия углеводородной цепи и
- 5. Получение простых эфиров Реакция Вильямсона (SN2): 3 5
- 6. Получение простых эфиров Межмолекулярная дегидратация первичных спиртов является одним из важнейших способов получения симметричных эфиров). Вторичные
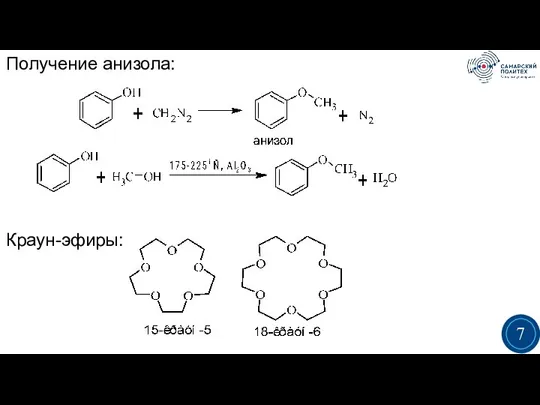
- 7. Получение анизола: Краун-эфиры: 3 7
- 8. ФИЗИЧЕСКИЕ СВОЙСТВА И СТРОЕНИЕ ПРОСТЫХ ЭФИРОВ Диметиловый эфир – газ остальные - бесцветные, подвижные, летучие жидкости
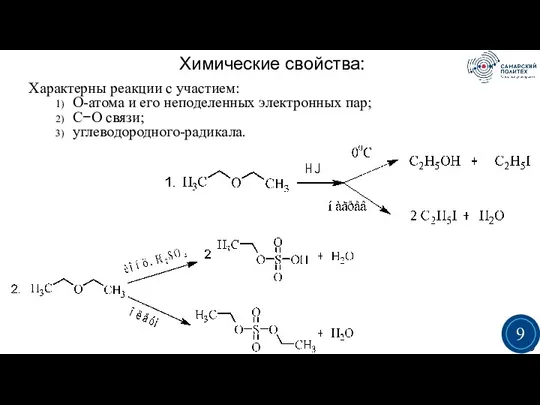
- 9. Химические свойства: Характерны реакции с участием: О-атома и его неподеленных электронных пар; С−О связи; углеводородного-радикала. 3
- 10. 4. Образование оксониевых соединений: благодаря наличию неподеленной электронной пары у атома кислорода эфиры могут присоединять протон
- 11. Реакции по углеводородному остатку В диалкиловых эфирах реакции (например, хлорирование при облучении) идут по aльфа С-атому,
- 12. Циклические простые эфиры. Органические окиси. Эпоксиды. Этиленоксид (>20 млн. т/год): tкип.=10°С, Енапр.=25 ккал/моль, d=0.897 Синтез эпоксидов
- 13. Химические свойства: Трехчленный цикл оксиранов характеризуется высокой степенью различных видов напряжений . Кроме того, в трехчленном
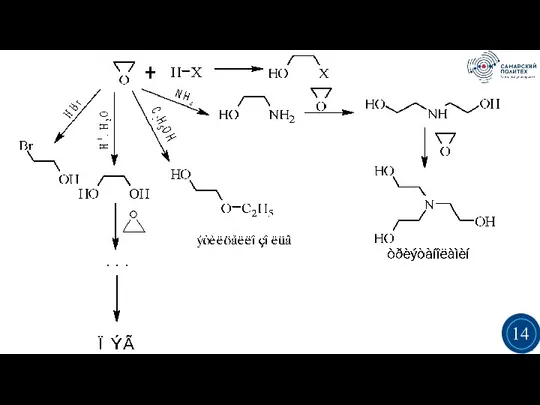
- 14. 3 3 14
- 15. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ ПРОСТЫХ ЭФИРОВ Диэтиловый эфир Диэтиловый эфир — бесцветная жидкость с приятным запахом, очень летуч,
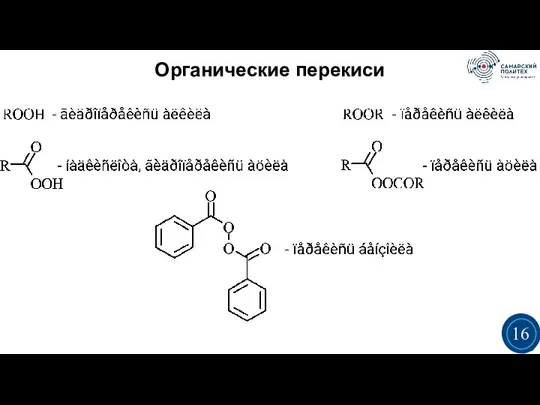
- 16. Органические перекиси 3 3 16
- 18. Скачать презентацию











 Пуриновые основания
Пуриновые основания Дождь из облака
Дождь из облака Биологические буферные системы
Биологические буферные системы Классификация неорганических соединений
Классификация неорганических соединений Сложные эфиры
Сложные эфиры Магматические породы
Магматические породы Что такое углеволокно (карбон) и как оно может спасти нас от нефтяного кризиса
Что такое углеволокно (карбон) и как оно может спасти нас от нефтяного кризиса Презентация на тему Платина
Презентация на тему Платина  Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях Разработка методов синтеза гомогенных катализаторов оксосинтеза бутиловых спиртов
Разработка методов синтеза гомогенных катализаторов оксосинтеза бутиловых спиртов Наука Химия на Великой Отечественной войне
Наука Химия на Великой Отечественной войне Основные понятия физической химии
Основные понятия физической химии Khim_8
Khim_8 Топливо и расчеты его горения
Топливо и расчеты его горения Экзаменационные билеты
Экзаменационные билеты Презентация на тему Предельные углеводороды
Презентация на тему Предельные углеводороды  Цианоакрилатовая камера для выявления жировых следов
Цианоакрилатовая камера для выявления жировых следов Периодическая система
Периодическая система Современные представления о механизме реакций отщепления. Спектр механизмов E1-E2-E1cB. Диаграммы Дженкса-О’Феррола
Современные представления о механизме реакций отщепления. Спектр механизмов E1-E2-E1cB. Диаграммы Дженкса-О’Феррола Основы МКТ
Основы МКТ Схема монооксигеназной цепи микросом
Схема монооксигеназной цепи микросом Синтез латексов
Синтез латексов Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Галогены
Галогены Стеклообразование, структура и свойства стекол системы Na2O – B2O3 – SiO2 на основе комплексного борсодержащего сырья
Стеклообразование, структура и свойства стекол системы Na2O – B2O3 – SiO2 на основе комплексного борсодержащего сырья Аппаратурное оформление процесса гидроочистки нефтяных фракций
Аппаратурное оформление процесса гидроочистки нефтяных фракций Тип кристаллической решетки у белого фосфора…. Тест
Тип кристаллической решетки у белого фосфора…. Тест Строение материалов. Дефекты кристаллической структуры
Строение материалов. Дефекты кристаллической структуры