Содержание
- 2. План урока Теория окислительно-восстановительных реакций. Классификация окислительно-восстановительных реакций. Расстановка коэффициентов методом электронного баланса.
- 3. Окислительно-восстановительными называются реакции, в ходе которых хотя бы один элемент изменил свою степень окисления.
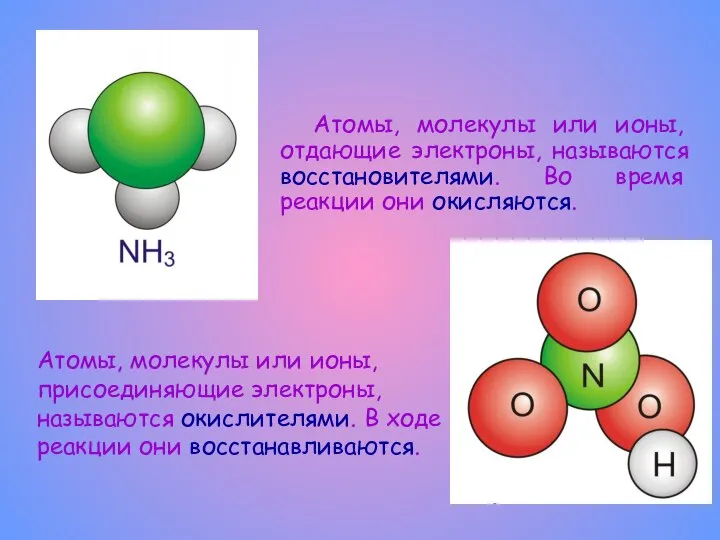
- 4. Атомы, молекулы или ионы, отдающие электроны, называются восстановителями. Во время реакции они окисляются. Атомы, молекулы или
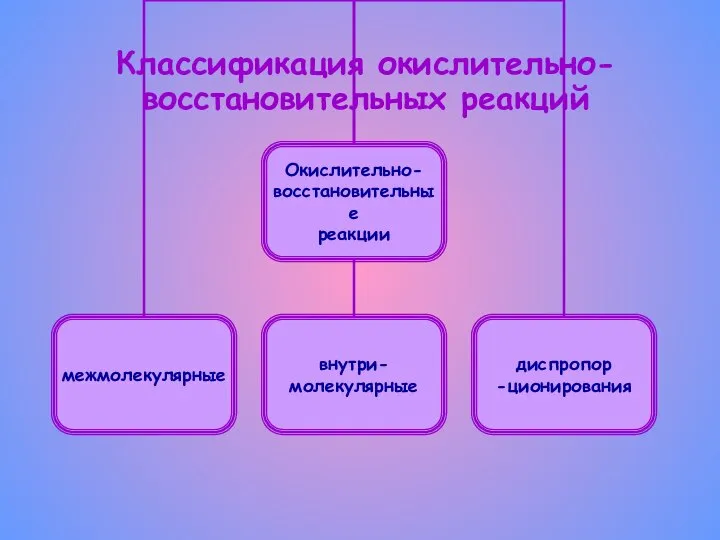
- 5. Классификация окислительно-восстановительных реакций
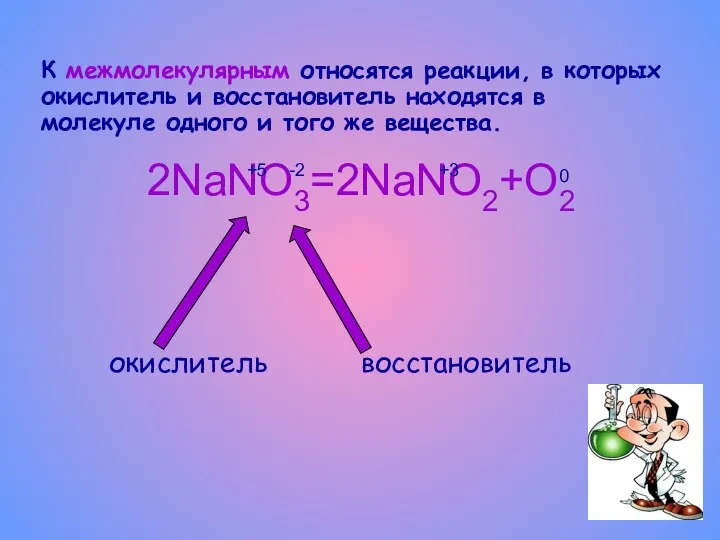
- 6. К межмолекулярным относятся реакции, в которых окислитель и восстановитель находятся в молекуле одного и того же
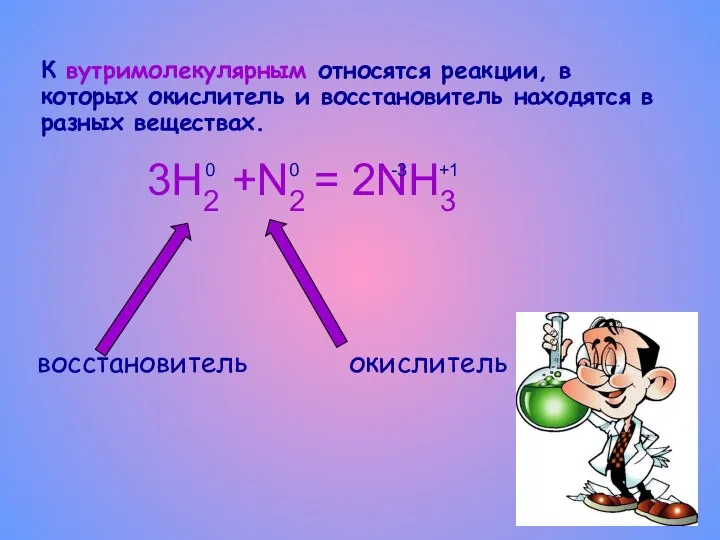
- 7. К вутримолекулярным относятся реакции, в которых окислитель и восстановитель находятся в разных веществах. 3Н2 +N2 =
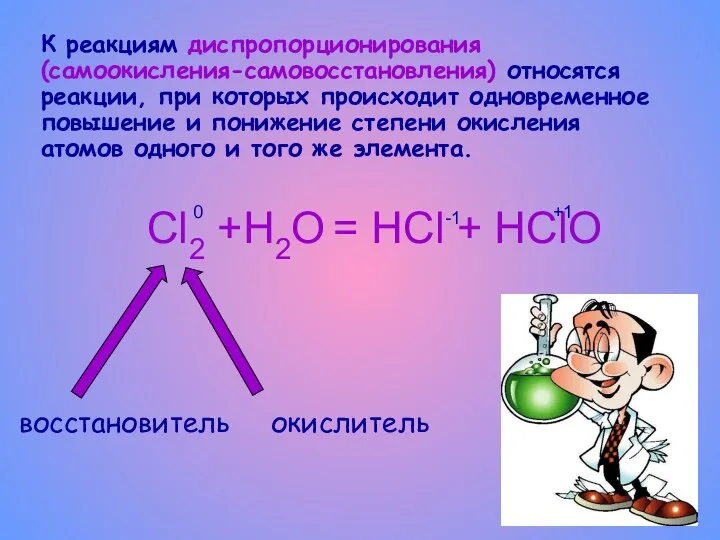
- 8. К реакциям диспропорционирования (самоокисления-самовосстановления) относятся реакции, при которых происходит одновременное повышение и понижение степени окисления атомов
- 9. Американский химик Роланд Стаут придумал тест на умение определять коэффициенты в окислительно-восстановительных реакция. Сумма коэффициентов в
- 10. 2 5 При расстановки коэффициентов методом электронного баланса придерживаются следующего алгоритма: Расставить степени окисления всех элементов.
- 12. Скачать презентацию




 Карбоновые кислоты, их строение, номенклатура, получение и свойства
Карбоновые кислоты, их строение, номенклатура, получение и свойства Типы химических реакций
Типы химических реакций Сода. Что я знаю о ней!?
Сода. Что я знаю о ней!? Элемент протактиний
Элемент протактиний Классификация реакций. Таблица
Классификация реакций. Таблица Спирты
Спирты Аммиак. Азот
Аммиак. Азот Образование первичной структуры белка
Образование первичной структуры белка Молярный объем газов
Молярный объем газов Ð¥ÐÐÐЧÐСÐÐÐ Ð ÐÐÐÐÐÐСÐÐ1
Ð¥ÐÐÐЧÐСÐÐÐ Ð ÐÐÐÐÐÐСÐÐ1 Химическая связь. Строение вещества
Химическая связь. Строение вещества Счастливый случай
Счастливый случай Соли (8 класс)
Соли (8 класс) Презентация по Химии "Алканолы"
Презентация по Химии "Алканолы"  Эквивалент. Закон эквивалентов
Эквивалент. Закон эквивалентов Галогены
Галогены Природный газ
Природный газ Задача №3: Трансмутация. Команда: Карбораны
Задача №3: Трансмутация. Команда: Карбораны ТЭЦ, работающие на каменном угле более экологичны, чем на буром. Факт или вымысел?
ТЭЦ, работающие на каменном угле более экологичны, чем на буром. Факт или вымысел? Презентация на тему Звездный час (9 класс)
Презентация на тему Звездный час (9 класс)  Углеводороды (УВ)
Углеводороды (УВ) Переработка нефти
Переработка нефти Коррозия металлов
Коррозия металлов Модели молекул
Модели молекул Альдегиды. Получение и применение. Общая формула альдегидов
Альдегиды. Получение и применение. Общая формула альдегидов Классификация неорганических веществ
Классификация неорганических веществ Домашняя работа на каникулы
Домашняя работа на каникулы Белки
Белки