Содержание
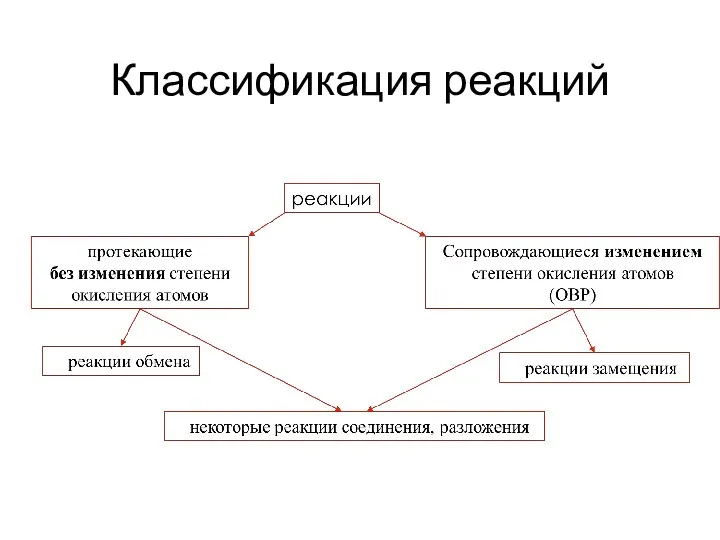
- 2. Классификация реакций
- 3. Классификация ОВР Межмолекулярные– __________________________________________________________________________________________
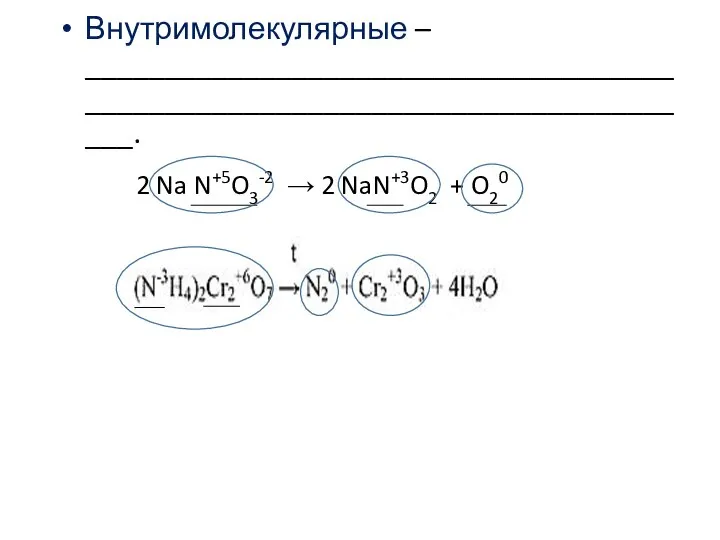
- 4. Внутримолекулярные – _____________________________________________________________________________. 2 Na N+5O3-2 → 2 NaN+3O2 + O20
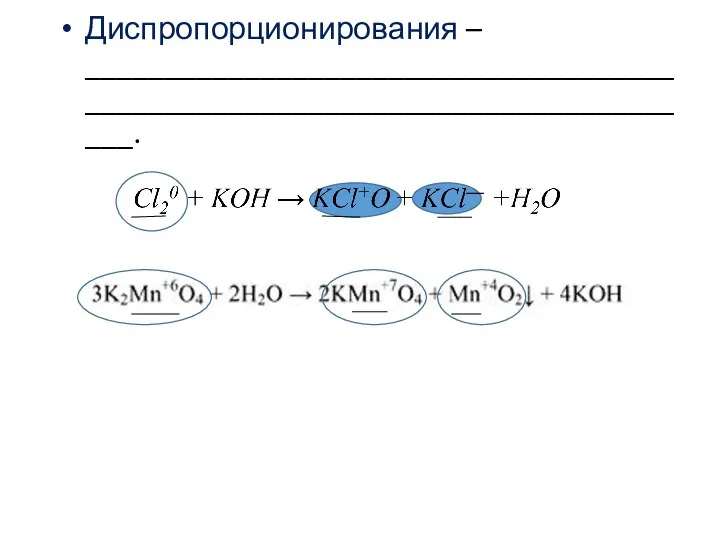
- 5. Диспропорционирования – _____________________________________________________________________________.
- 6. S+4O2 + 2H2S-2 → 3S0 + 2H2O S+4 + 4ē → S0 S−2 – 2ē →
- 7. Окислительно - восстановительные реакции (ОВР) Реакции, протекающие с изменением степени окисления, называются _________________________________________. Степень окисления –
- 8. «─» степень окисления имеют атомы, которые приняли электроны от других атомов или в их сторону смещены
- 9. Правила определения степени окисления самый электроотрицательный элемент, во всех соединениях -1 за исключением гидридов металлов постоянная
- 11. Атомы элементов главных подгрупп IV-VI групп могут проявлять несколько степеней окисления. Высшую «+», равную номеру группы
- 12. Атомы металлов могут иметь только «+» степень окисления. Атомы элементов VII группы, главной подгруппы –галогены (кроме
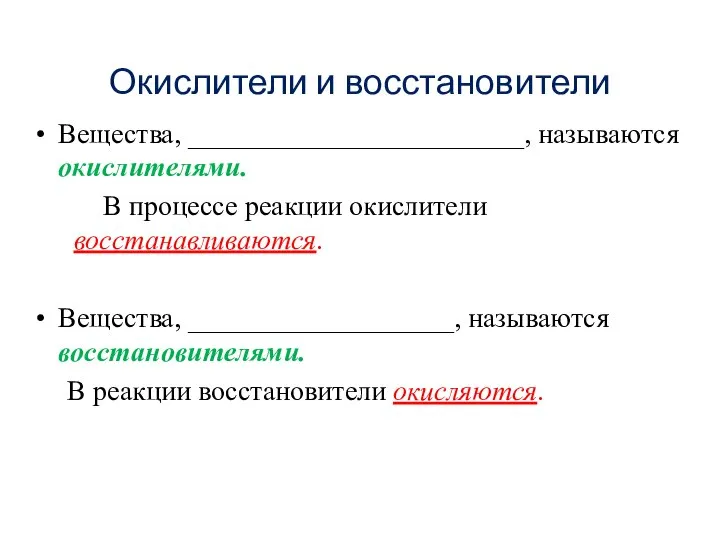
- 13. Окислители и восстановители Вещества, ________________________, называются окислителями. В процессе реакции окислители восстанавливаются. Вещества, ___________________, называются восстановителями.
- 14. Окислителями могут быть: Неметаллы в свободном состоянии; Неметаллы и металлы в высшей степени окисления; КМn+7О4 ;
- 15. Восстановителями могут быть: Металлы и водород в свободном состоянии; Наиболее активными восстановителями являются щелочные и щелочноземельные
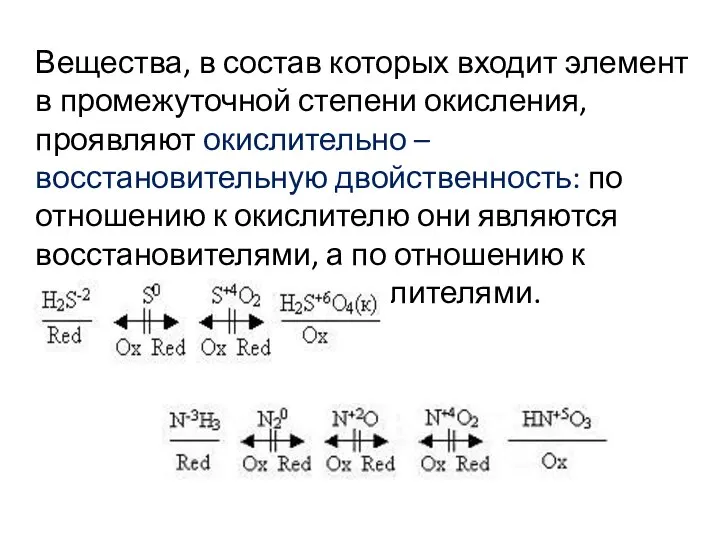
- 16. Вещества, в состав которых входит элемент в промежуточной степени окисления, проявляют окислительно – восстановительную двойственность: по
- 17. Процесс окисления и восстановления Окислением называется процесс отдачи электронов, степень окисления атома при этом повышается: Al0
- 18. СОСТАВЛЕНИЕ УРАВНЕНИЙ ОКИСЛИТЕЛЬНО- ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ Для составления уравнений окислительно-восстановительных реакций часто используется специальный метод — метод
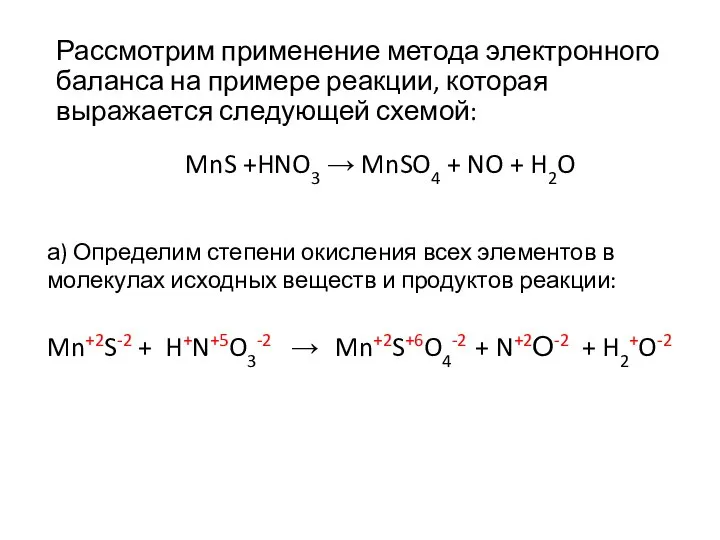
- 19. Рассмотрим применение метода электронного баланса на примере реакции, которая выражается следующей схемой: MnS +HNO3 → MnSO4
- 20. б) Подчеркнем символы элементов, которые изменяют степени окисления в ходе реакции: MnS-2 + HN+5O3 → MnS+6O4
- 21. г) Находим множители для уравнений процессов окисления и восстановления, при умножении на которые числа отданных и
- 22. е) После этого уравниваем числа атомов элементов, которые не изменяют степени окисления. В данном случае это
- 23. Составим уравнение реакции, которая протекает по следующей схеме: Cu + HNO3→Cu(NO3)2 + NO + Н2О 1)
- 24. Найденные методом электронного баланса коэффициенты напишем перед всеми формулами, содержащими Cu и N, кроме формулы HNO3,
- 25. В некоторых ОВР более двух элементов изменяют свои степени окисления. Два элемента — фосфор и сера
- 26. Запишем эти множители качестве коэффициентов перед формулами соответствующих веществ: В заключение уравняем числа атомов водорода и
- 27. Ионно-электронный метод (метод полуреакций) При написании ионно-молекулярных уравнений, сильные электролиты записывают в виде ионов, а слабые
- 29. Если исходный ион или молекула содержат больше атомов кислорода, чем продукт реакции, то избыток атомов кислорода:
- 31. Рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в кислой среде. 1. Сначала
- 32. 3. Далее определим окислитель и восстановитель и составим полуреакции процессов восстановления и окисления. В приведенной реакции
- 33. Находим коэффициент для окислителя и восстановителя, учитывая, что окислитель присоединяет столько электронов, сколько отдает восстановитель в
- 34. 5. Затем необходимо просуммировать обе полуреакции, предварительно умножая на найденные коэффициенты, получаем: 2MnO4-+16H+ +5SO32-+5H2O = 2Mn2++8H2O+5SO42-+10H+
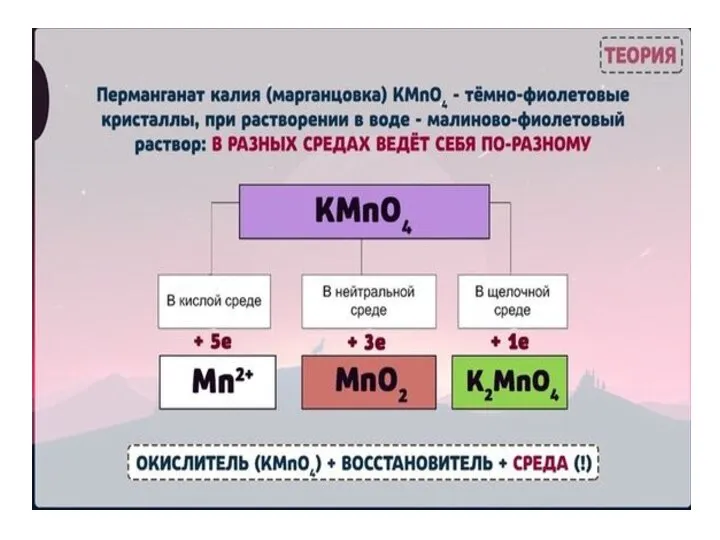
- 35. Далее рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в нейтральной среде. Na2S+4O3
- 36. Полуреакции имеют следующий вид: MnO4— + 2H2O + 3ē = MnО2 ↓+ 4OH— ¦2 малиново-фиолетовый бурый
- 37. И еще один пример — составление уравнения реакции между сульфитом натрия и перманганатом калия в щелочной
- 39. Скачать презентацию





























 Алкены. Гомологический ряд алкенов. Изомерия алкенов
Алкены. Гомологический ряд алкенов. Изомерия алкенов Химия. Зачем она нужна? Дистанционный конкурс «Химия без лаборатории» Ученица 10 класса Климашина Василиса, ГОУСОШ № 464 – ЦАО, г. М
Химия. Зачем она нужна? Дистанционный конкурс «Химия без лаборатории» Ученица 10 класса Климашина Василиса, ГОУСОШ № 464 – ЦАО, г. М Уравнение состояния идеального газа. Газовые законы. Изопроцессы
Уравнение состояния идеального газа. Газовые законы. Изопроцессы Щелочно-земельные металлы и магний
Щелочно-земельные металлы и магний Метанол. Способы получения
Метанол. Способы получения Свинец (plumbum)
Свинец (plumbum)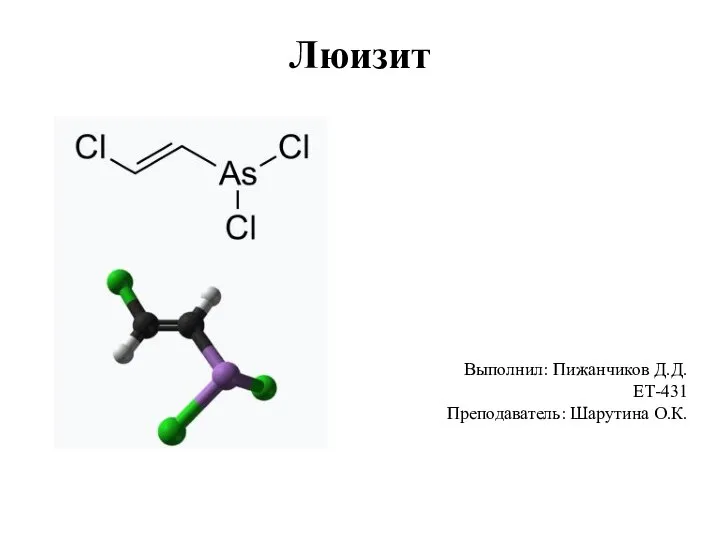 Люизит. Физические и химические свойства вещества. Действие на организм человека
Люизит. Физические и химические свойства вещества. Действие на организм человека Презентация на тему Подготовка к ЕГЭ. Полезно знать
Презентация на тему Подготовка к ЕГЭ. Полезно знать  Изотопная геохимия. Лекция 4-5
Изотопная геохимия. Лекция 4-5 Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу
Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу Степень окисления
Степень окисления Железо. Физические свойства
Железо. Физические свойства Хімічна промисловість
Хімічна промисловість Кислородосодержащие органические соединения. Cпирты (алканолы)
Кислородосодержащие органические соединения. Cпирты (алканолы) Презентация на тему Свойства простых веществ
Презентация на тему Свойства простых веществ  Количество теплоты, для получения углекислого газа. Химическое равновесие. Примеры. (Лекция 4)
Количество теплоты, для получения углекислого газа. Химическое равновесие. Примеры. (Лекция 4) Аллотропия углерода
Аллотропия углерода Растворы. Типы растворов. Способы выражения концентрации растворов
Растворы. Типы растворов. Способы выражения концентрации растворов Химия 9 класс. Введение - повторение
Химия 9 класс. Введение - повторение Великий кислород
Великий кислород Углеводы
Углеводы Углеводороды. Общие знания
Углеводороды. Общие знания Характеристика кислорода и серы
Характеристика кислорода и серы Энергетический обмен
Энергетический обмен Вода
Вода Тип кристаллической решетки у белого фосфора…. Тест
Тип кристаллической решетки у белого фосфора…. Тест Природные кислоты и щелочи. Индикаторы
Природные кислоты и щелочи. Индикаторы Разработка математического описания расчета октанового числа бензинов каталитического риформинга с групповой кинетикой
Разработка математического описания расчета октанового числа бензинов каталитического риформинга с групповой кинетикой