Слайд 2Теплота и энергия
Химические процессы всегда сопровождаются выделением или поглощением энергии
Теплота (Q) –

это энергия, которая переходит от одного тела к другому между телами с разной температурой, другими словами, мера переноса энергии между телами при разнице температур
Внутренняя энергия (U) −энергия, запасенная в веществе.
Слайд 3Теплота и внутренняя энергия

Слайд 4Задачи кинетики:
Измерение скорости реакции и выявление ее зависимости от условий эксперимента. Определение

порядка реакции, энергии активации.
Установление механизма реакции и определение характеристик отдельных элементарных стадий
Установление связи между строением вещества и его реакционной способностью
Слайд 5Отличие термодинамики от кинетики
1. В термодинамике нет времени. Кинетика изучает динамические системы, изменяющиеся

во времени.
2. В термодинамике важна как левая, так и правая часть уравнения. В кинетике только левая. Скорость реакции определяется только состоянием исходных веществ и условиями эксперимента.
3. В термодинамике используют активность реагентов, а в кинетике только концентрации.
Слайд 6Скорость реакции
По мере протекания химической реакции
aA+ bB+ …= cC + dD

+ …
количества исходных веществ(A,B) уменьшаются, а количества продуктов(C, D) –увеличиваются.
Скорость элементарной химической реакции (r) определяют как число превращений, происходящих в единицу времени в единице реакционного пространства (V, S)
Для возможности сравнения скорость нормируют на V или S
Слайд 7Кинетические кривые
а с
Зависимость концентрации исходных веществ (а) и продуктов (с) от времени
Средняя
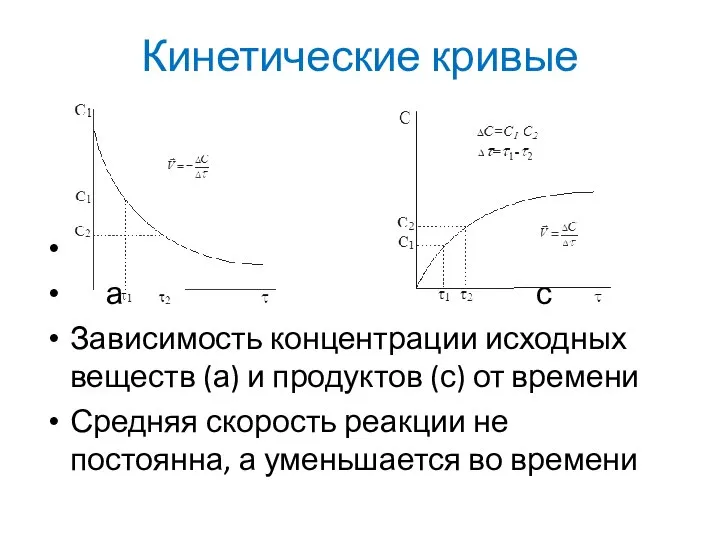
скорость реакции не постоянна, а уменьшается во времени
Слайд 8Факторы, от которых зависит скорость реакции
1. Природа веществ
2. Концентрации веществ (давление -

для газофазных реакций)
3. Температура
4. Энергия активации
5. Катализаторы
6. Степень измельчённости – для гетерогенных процессов
Слайд 9Природа веществ и скорость реакции
С наибольшей скоростью реагируют вещества (неорганические и органические)

с ионными, полярными ковалентными связями. Взаимодействия органических веществ с ковалентными малополярными связями протекают значительно медленнее. В растворах электролитов реакции протекают быстро, т.к. реагируют ионы.
Слайд 10Скорость реакции и концентрация
Закон действующих масс (ЗДМ)
при постоянной температуре скорость реакции прямо

пропорциональна произведению концентраций реагирующих веществ, в степенях, равных порядку реакции по этим веществам. Порядок реакции по каждому из реагентов определяют экспериментально.
Как записать ЗДМ (кинетическое уравнение)?
Слайд 11Константа скорости-что это?
Это кинетическое уравнение для реакции
k – константа скорости реакции,

которая численно равна скорости реакции при концентрации каждого из реагентов равной 1 моль/л. Константа скорости характеризует скорость данного процесса при данной температуре; не зависит от концентрации реагентов, зависит от температуры – возрастает с ростом температуры
x и y порядки реакции по веществам А и В
Слайд 12Влияние температуры
Влияние температуры на скорость химических реакций упрощённо описывается правилом Вант-Гоффа (1884

г.): при повышении температуры на каждые 10 градусов скорость гомогенной реакции возрастает примерно в 2-4 раза.
Справедливо только для реакций, идущих с измеримой скоростью (не слишком быстрых или медленных, идущих не более одного рабочего для. Для геологических процессов, идущих тысячелетиями не выполняется).
γ – температурный коэффициент Вант-Гоффа
Слайд 13Почему скорость реакции зависит от температуры и концентрации

Слайд 14Энергия активации и скорость реакции
Чем больше E a, тем сильнее зависит от

температуры скорость реакции
Слайд 15Катализ
Энергетический профиль реакции в отсутствие и в присутствии катализатора. Катализ– ускорение реакции
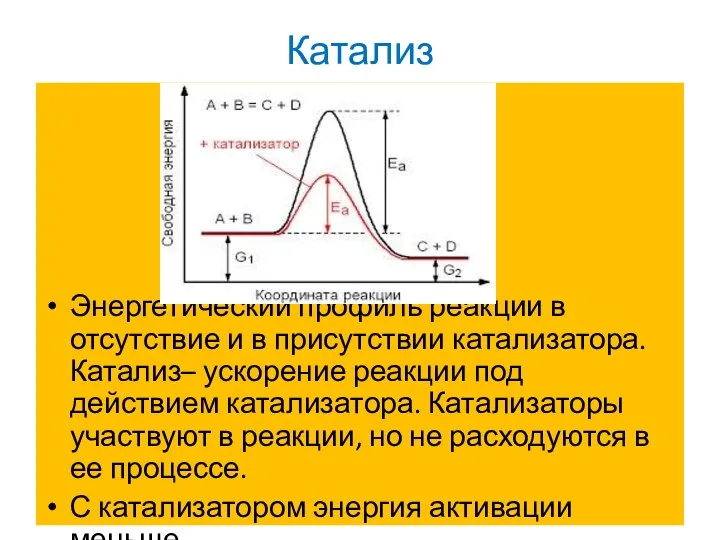
под действием катализатора. Катализаторы участвуют в реакции, но не расходуются в ее процессе.
С катализатором энергия активации меньше
Слайд 17Необратимые реакции
Необратимыми называются реакции, которые протекают только в одном направлении и идут

до конца.
1. Реакции двойного обмена с образованием малорастворимого вещества
NaCl + AgNO3 = NaNO3 + AgCl↓
2.Реакции с образованием газообразных веществ
Na2CO3 + 2HCl = 2NaCl + H2O + СO2↑
3. Реакции с образованием малодиссоциирующих веществ
HNO3 + KOH = KNO3 + H2O
4.Ионные реакции окисления – восстановления
Zn + H2SO4 = ZnSO4 + H2
5. Реакции, сопровождающиеся выделением большого количества энергии
C6H12O6 + 6O2 = 6СO2 + 6H2O Δr H= -2867кДж/моль
Слайд 18Обратимая химическая реакция
Протекает в двух направлениях одновременно: от исходных веществ к продуктам

и от продуктов к исходным веществам:
Исходные вещества ↔ продукты
Постепенно концентрация исходных веществ уменьшается, а продуктов–растет
Снижается скорость прямой реакции и растет скорость обратной реакции. В итоге скорости сравниваются - состояние равновесия.
Слайд 19Скорости прямой и обратной обратимой реакции
При постоянной температуре в реакционной смеси одновременно

присутствуют как исходные вещества, так и продукты, их концентрации (равновесные концентрации) сопоставимы и с течением времени не изменяются. К равновесию можно прийти как со стороны исходных веществ, так и со стороны продуктов.
Слайд 20Равновесие
Для обратимых реакций наступает состояние химического равновесия, если изменение свободной энергии Гиббса

равно нулю:
ΔG = 0.
Химическое равновесие является динамическим. В состоянии химического равновесия скорость прямой реакции равна скорости обратной реакции. Обратимость реакции отмечается знаком «обратимость» (↔ ), например:
3Н2 + N2↔ 2NН3.
Количественной характеристикой химического равновесия является константа химического равновесия (Кр).
Слайд 21Синтез аммиака
Обратимая химическая реакция
N2 + 3H2 ↔ 2NH3
В итоге образуется смесь

N2, H2 иNH3
В состоянии равновесия скорость прямой и обратной реакции одинаковы и не равны нулю.
Для увеличения выхода аммиака увеличивают Т и вводят катализатор
Слайд 22Смещение химического равновесия
Исходные вещества ↔ продукты.
При увеличении концентрации исходных веществ

увеличивается скорость прямой реакции.
Образуется дополнительное количество продуктов. Скорость обратной реакции увеличивается и снова устанавливается равновесие, но уже при других равновесных концентрациях. Равновесие смещается в сторону образования продуктов
Слайд 23Влияние температуры на смещение равновесия в экзотермической реакции
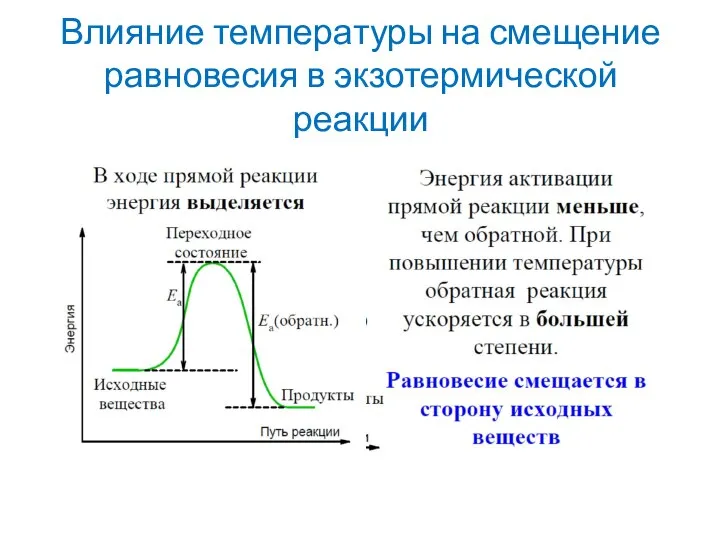
Слайд 25Термодинамический критерий химического равновесия
ΔrG = 0
При этом ΔrG° ≠ 0 !
Устанавливаются
постоянные
равновесные
концентрации, отличные
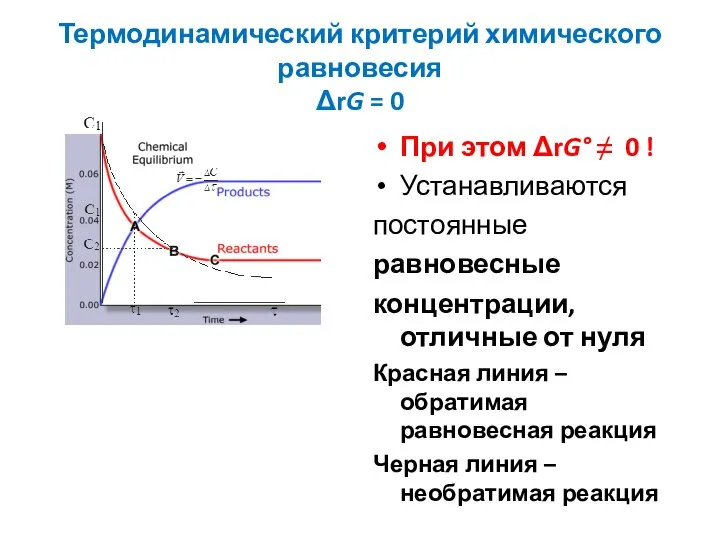
от нуля
Красная линия – обратимая равновесная реакция
Черная линия – необратимая реакция
Слайд 26Константа равновесия
Как записывается выражение для Кр: дробь:
в числителе – концентрации растворенных

и парциальные давления газообразных продуктов в степенях стехиометрических коэффициентов,
в знаменателе – концентрации растворенных и парциальные давления газообразных исходных веществ в степенях стехиометрических коэффициентов.
Слайд 27Примеры
Пример: растворение O2 в воде
O2(г.) ↔ O2(р.)
С(O2) − равновесная концентрация O2

в растворе
Смещение равновесия
2NO2 ↔ N2O4 + Q; ΔН<0 реакция экзотермическая
c ростом T уменьшается K,
равновесие смещается в сторону исходных веществ


























 Алюминий и алюминиевые сплавы
Алюминий и алюминиевые сплавы Металлы и их соединения
Металлы и их соединения Презентация на тему Микроэлементы: Хром, Йод, Фтор
Презентация на тему Микроэлементы: Хром, Йод, Фтор  Презентация на тему Основные законы науки химии
Презентация на тему Основные законы науки химии  Презентация на тему Каучук
Презентация на тему Каучук  Основания
Основания Ионная связь
Ионная связь Предельные углеводороды
Предельные углеводороды Презентация на тему Расчеты по химическим уравнениям
Презентация на тему Расчеты по химическим уравнениям  Расчетная работа. Тепловой эффект клинкерообразования
Расчетная работа. Тепловой эффект клинкерообразования Индолы. Cтроение индола
Индолы. Cтроение индола Ароматические гетероциклические соединения
Ароматические гетероциклические соединения Первый закон термодинамики. Термохимия
Первый закон термодинамики. Термохимия Презентация на тему Арены (10 класс)
Презентация на тему Арены (10 класс)  Углерод. Положение в ПС и особенности строения атома
Углерод. Положение в ПС и особенности строения атома Химия. (Задачи)
Химия. (Задачи) ВПР – это интересно
ВПР – это интересно Химическая связь
Химическая связь Общие сведения о питании и приготовлении пищи
Общие сведения о питании и приготовлении пищи Силумины. Виды силуминов
Силумины. Виды силуминов Тестовая работа по теме: Реакции ионного обмена. Химия. 9 класс
Тестовая работа по теме: Реакции ионного обмена. Химия. 9 класс Химия. Подготовка к контрольной работе
Химия. Подготовка к контрольной работе Белки
Белки Строение атома. История открытия
Строение атома. История открытия Оценка пригодности природной воды в качестве питьевой по формуле М.Г. Курлова
Оценка пригодности природной воды в качестве питьевой по формуле М.Г. Курлова Показатели обогащения
Показатели обогащения Презентация по Химии "Незнайка в стране химия"
Презентация по Химии "Незнайка в стране химия"  Study of short peptide adsorption on solution dispersed. Inorganic nanoparticles using depletion method
Study of short peptide adsorption on solution dispersed. Inorganic nanoparticles using depletion method