Содержание
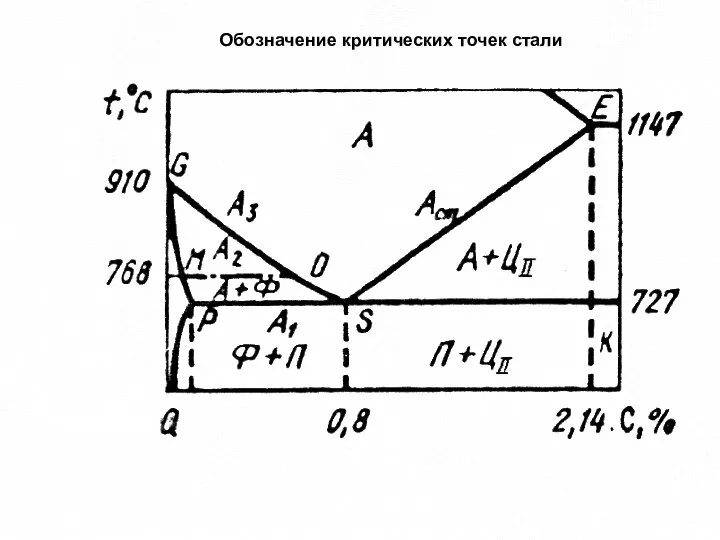
- 2. Обозначение критических точек стали
- 3. 2 Критические точки А1 лежат на линии PSK (727°C) и соответствует превращению аустенит → перлит. Критические
- 4. аустенит (А) — твердый раствор углерода в γ-железе Feγ(С); мартенсит (М) — твердый раствор углерода в
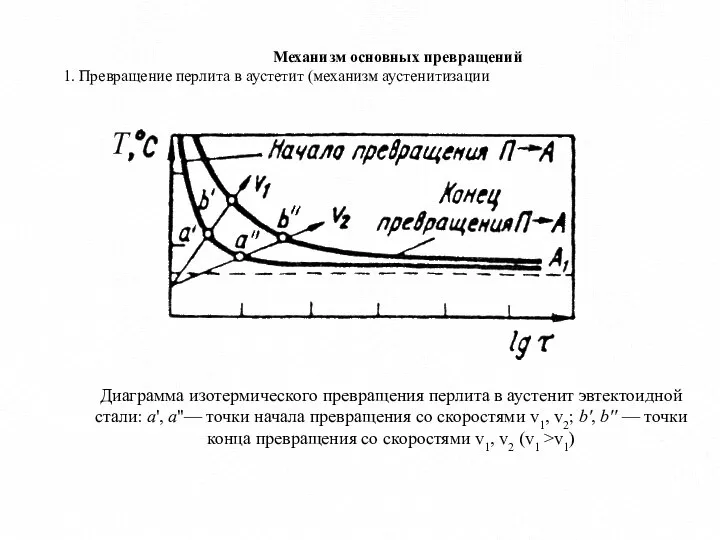
- 5. Механизм основных превращений 1. Превращение перлита в аустетит (механизм аустенитизации Диаграмма изотермического превращения перлита в аустенит
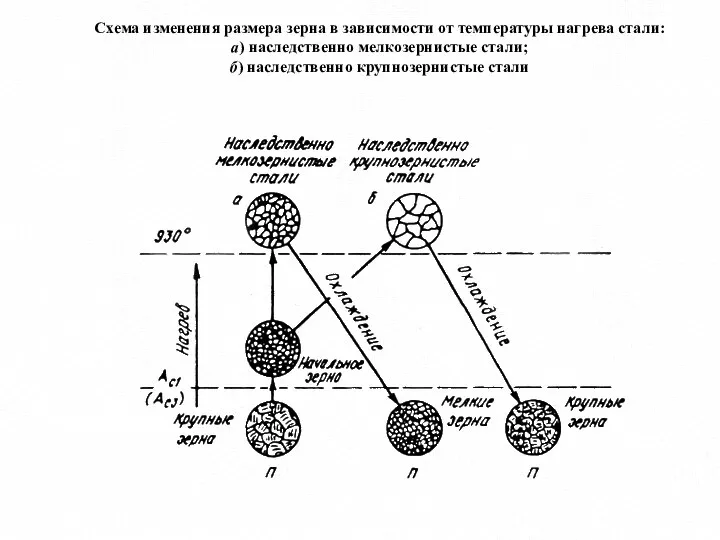
- 6. Схема изменения размера зерна в зависимости от температуры нагрева стали: а) наследственно мелкозернистые стали; б) наследственно
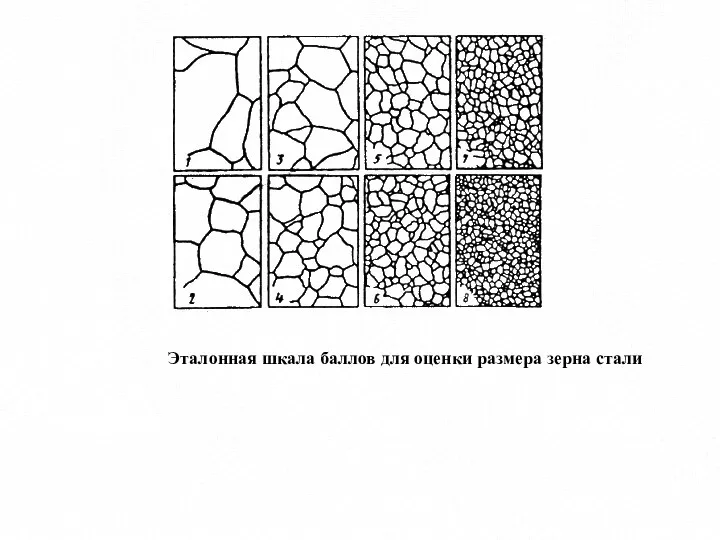
- 7. Эталонная шкала баллов для оценки размера зерна стали
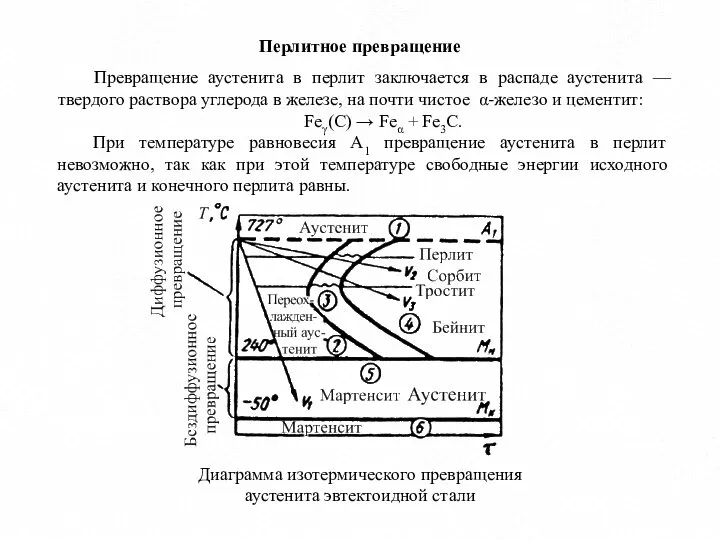
- 8. Перлитное превращение Превращение аустенита в перлит заключается в распаде аустенита — твердого раствора углерода в железе,
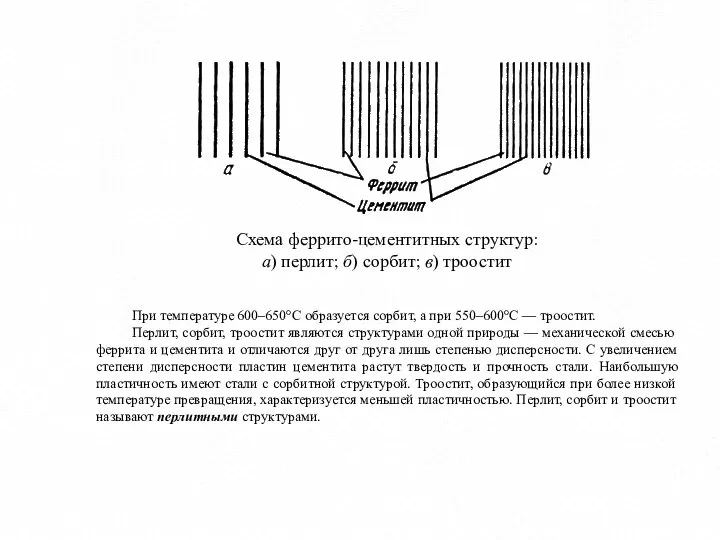
- 9. Схема феррито-цементитных структур: а) перлит; б) сорбит; в) троостит При температуре 600–650°С образуется сорбит, а при
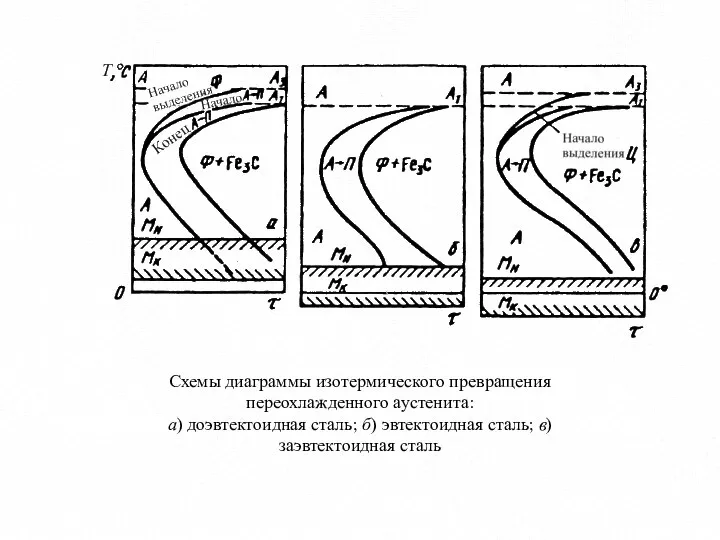
- 10. Схемы диаграммы изотермического превращения переохлажденного аустенита: а) доэвтектоидная сталь; б) эвтектоидная сталь; в) заэвтектоидная сталь
- 11. Промежуточное превращение При температуре ниже 550oС самодиффузия атомов железа практически не происходит, а атомы углерода обладают
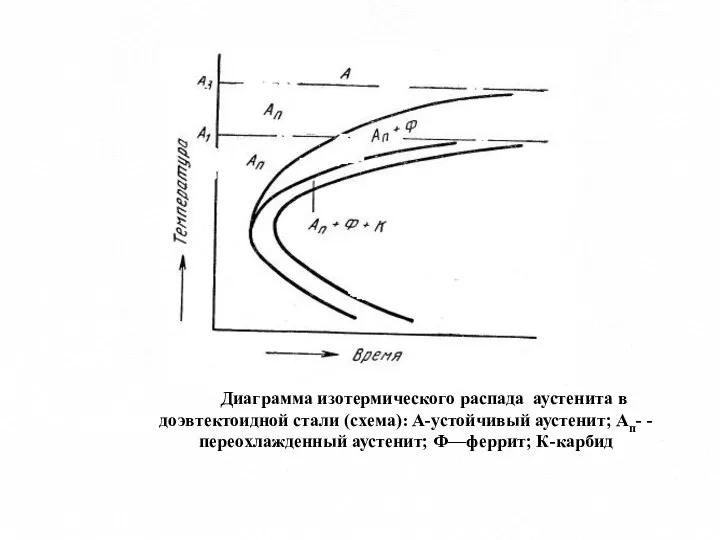
- 12. Диаграмма изотермического распада аустенита в доэвтектоидной стали (схема): А-устойчивый аустенит; Ап- - переохлажденный аустенит; Ф—феррит; К-карбид
- 13. Видманштеттов феррит образуется в интервале от А3 минус 50° С до 600—550°С. С увеличением содержания углерода
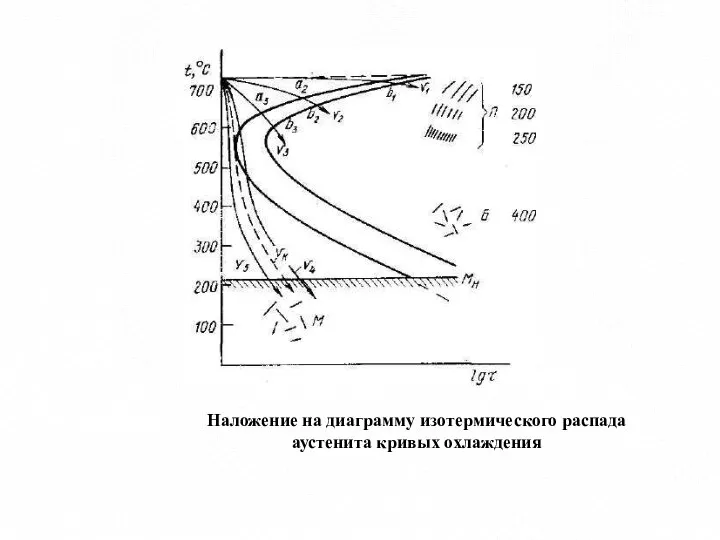
- 14. Наложение на диаграмму изотермического распада аустенита кривых охлаждения
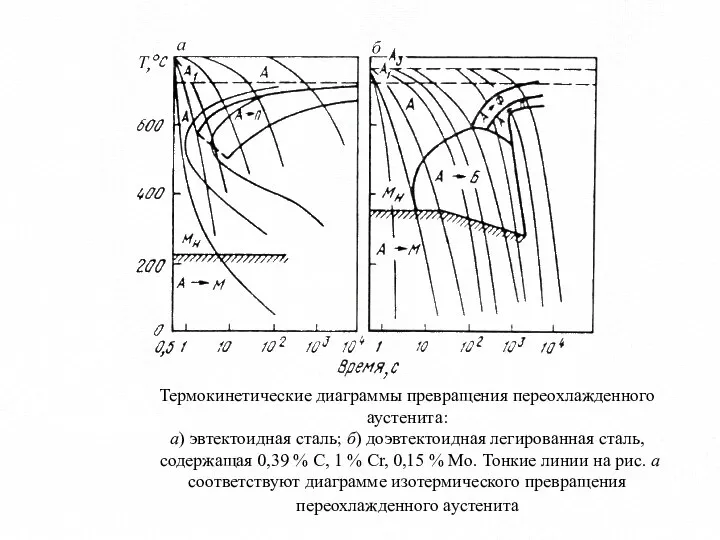
- 15. Термокинетические диаграммы превращения переохлажденного аустенита: а) эвтектоидная сталь; б) доэвтектоидная легированная сталь, содержащая 0,39 % С,
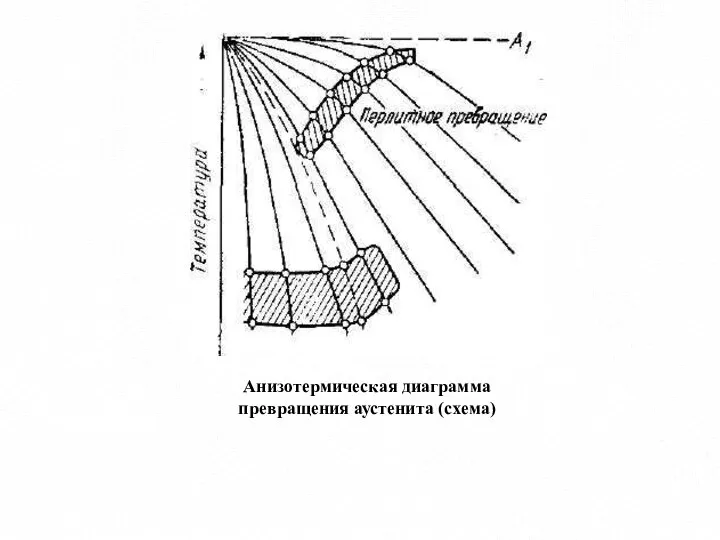
- 16. Анизотермическая диаграмма превращения аустенита (схема)
- 18. Скачать презентацию




 Обобщение знаний об основных классах неорганических соединений
Обобщение знаний об основных классах неорганических соединений X-Ray Diffraction in Biology (XRD). Физический принцип кристаллографии
X-Ray Diffraction in Biology (XRD). Физический принцип кристаллографии Натуральный каучук
Натуральный каучук Алкены
Алкены Ароматические углеводороды
Ароматические углеводороды Презентация на тему Хлор
Презентация на тему Хлор  Соединения Ca и Mg, представителей элементов II группы главной подгруппы
Соединения Ca и Mg, представителей элементов II группы главной подгруппы Любовь и химия
Любовь и химия Презентация на тему Занимательная химия
Презентация на тему Занимательная химия  Ароматические вещества и их значение для человека
Ароматические вещества и их значение для человека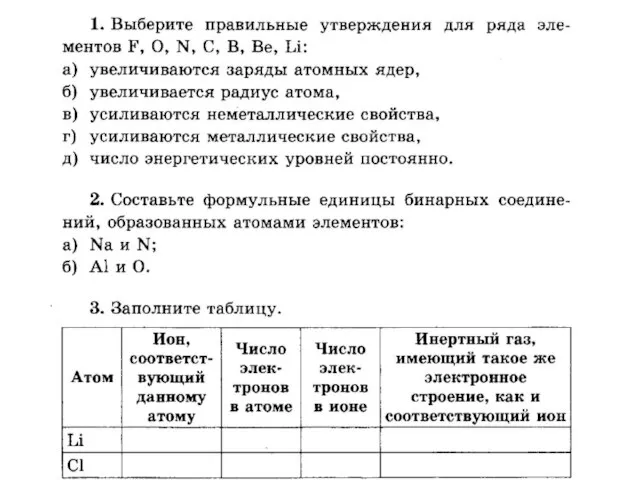 Взаимодействие атомов элементов-неметаллов между собой
Взаимодействие атомов элементов-неметаллов между собой Водород. Вода
Водород. Вода Технология растворов на неводных растворителях
Технология растворов на неводных растворителях Общие химические свойства металлов
Общие химические свойства металлов Металлургия
Металлургия Амины и анилин
Амины и анилин Сущность химических реакций и признаки их протекания
Сущность химических реакций и признаки их протекания Свойства химической связи
Свойства химической связи Углеводы. Глюкоза. 10 класс
Углеводы. Глюкоза. 10 класс Применение углерода
Применение углерода علاوي الندوة
علاوي الندوة Альдегиды
Альдегиды Кислоты. Кислоты, вокруг нас
Кислоты. Кислоты, вокруг нас Изменения, происходящие с веществами. Физические явления в химии
Изменения, происходящие с веществами. Физические явления в химии Натуральные и синтетические каучуки
Натуральные и синтетические каучуки Физико-химия поверхностных явлений в функционировании живых систем
Физико-химия поверхностных явлений в функционировании живых систем Презентация на тему Химические волокна
Презентация на тему Химические волокна  Внеклассное мероприятие по химии. Своя игра
Внеклассное мероприятие по химии. Своя игра