Слайд 2Кислоты
Тема урока:
«Химические свойства кислот в свете теории электролитической диссоциации».
«От кислых яблок

сразу скисну».
В. Шекспир
Слайд 3Задачи урока
Образовательная: изучить химические свойства кислот с позиции теории электролитической диссоциации.
2.

Развивающие (формирование и развитие образовательных компетенций):
а) учебно-познавательных: развитие навыков самостоятельной познавательной деятельности; умения ставить познавательную задачу, умения добывать знания, выделять главное, обобщать, делать выводы, проводить самопроверку и самооценку;
б) коммуникативных: навыков работы в паре, взаимодействия с другими людьми, умения ответить на поставленный вопрос;
в) информационных: проводить материальное и знаковое моделирование, выделять существенные признаки химических реакций, извлекать необходимую информацию из проводимого эксперимента; оформлять и представлять результаты своей работы.
3. Воспитательные: воспитывать сознательное отношение к учебному труду, чувство ответственности, развивать интерес к знаниям.
4. Здоровьесберегающие: закрепить навыки безопасного обращения с реактивами.
Слайд 4Планируемые результаты обучения
В результате изучения данного материала учащиеся должны:
Знать:
а) определение понятий –

электролиты, неэлектролиты, электролитическая диссоциация, кислоты;
б) химические свойства кислот с позиции теории электролитической диссоциации.
Уметь (владеть способами познавательной деятельности):
а) составлять уравнения электролитической диссоциации кислот, оснований, солей;
б) уравнения реакций ионного обмена;
в) проводить реакции ионного обмена, подтверждающие химические свойства кислот, соблюдая правила безопасного обращения с реактивами и выявлять признаки наблюдаемых химических реакций;
г) пользоваться таблицей растворимости.
Слайд 5Правила техники безопасности
Осторожно обращайтесь с химическим оборудованием!
Запрещается пробовать вещества на вкус (а);

брать вещества руками (б);
оставлять открытыми склянки с жидкостями и банки с сухими веществами (в);
высыпать или выливать остатки реактивов в склянки и банки, из которых
они были взяты (г); оставлять неубранными рассыпанные или разлитые реактивы (д); менять пробки и пипетки от различных банок или склянок (е). Надо работать
только над столом (ж); смыть водой, затем нейтрализующим веществом реактив,
если он попал на кожу или одежду (з); собирать остатки веществ в специально предназначенную посуду (и)
Слайд 6Цели:
проделать реакции, характерные для кислот на примере серной кислоты, соляной кислоты.
сделать

вывод о химических свойствах кислот,
закрепить навыки безопасного обращения с реактивами.
Слайд 7Взаимодействие кислот с индикаторами
Красный

Слайд 8Взаимодействие кислот с металлами
2HCl + Zn = ZnCl2 + H2

Слайд 9Взаимодействие кислот с основаниями
Cu(OH)2 + 2HCl = CuCl2 + 2H2 O

Слайд 10Взаимодействие кислот с солями
Na2 CO3 + H2 SO4 = H2 O +

CO2 + Na2 SO4









 Коллоидно-химическая теория схватывания и твердения вяжущих веществ
Коллоидно-химическая теория схватывания и твердения вяжущих веществ Основы неорганической химии
Основы неорганической химии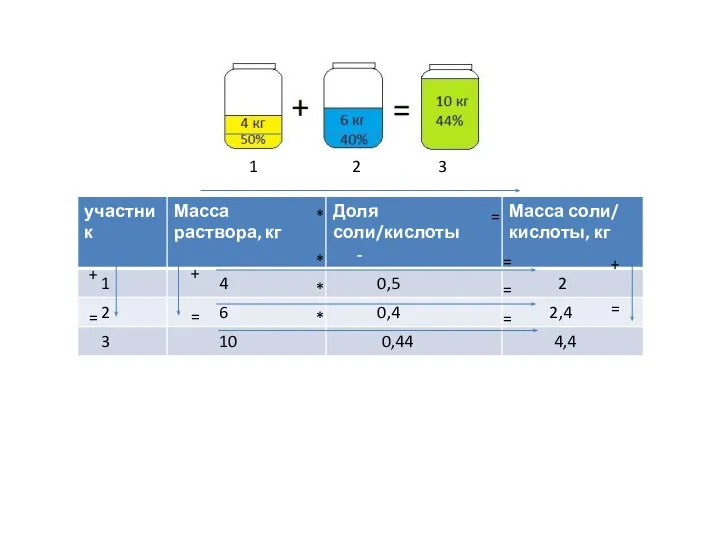 Концентрация растворов
Концентрация растворов Закон сохранения массы веществ
Закон сохранения массы веществ Презентация на тему Глицерин
Презентация на тему Глицерин  Образование раствора
Образование раствора Кристаллы. Формирование кристаллов
Кристаллы. Формирование кристаллов Металлом называется светлое тело, которое ковать можно
Металлом называется светлое тело, которое ковать можно Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Магний и кальций
Магний и кальций Углерод
Углерод Классы неорганических веществ. Оксиды
Классы неорганических веществ. Оксиды Классификация спиртов. Изомерия спиртов
Классификация спиртов. Изомерия спиртов Карбоновые кислоты (химические свойства)
Карбоновые кислоты (химические свойства) Стекло. Определение стекла
Стекло. Определение стекла Общая характеристика элементов подгруппы углерода. Углерод – его строение и свойства
Общая характеристика элементов подгруппы углерода. Углерод – его строение и свойства Кислоты, их классификация и свойства
Кислоты, их классификация и свойства Серная кислота H2SO4
Серная кислота H2SO4 Презентация на тему Викторина по химии "Что это?"
Презентация на тему Викторина по химии "Что это?" 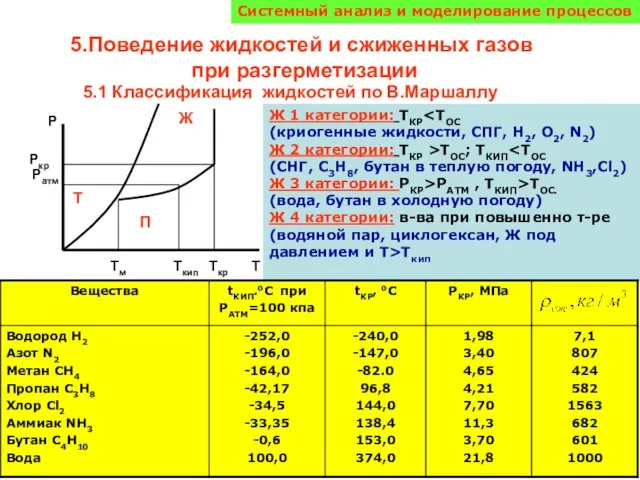 Поведение жидкостей и сжиженных газов при разгерметизации
Поведение жидкостей и сжиженных газов при разгерметизации Классификация химических реакций
Классификация химических реакций Производство серной кислоты
Производство серной кислоты Степень окисления
Степень окисления Водород. Свойства, применение
Водород. Свойства, применение Пропиловый спирт C3H7OH
Пропиловый спирт C3H7OH Общая характеристика галогенов на основе положения химических элементов в периодической системе
Общая характеристика галогенов на основе положения химических элементов в периодической системе 1399920
1399920 Виды металлов, сплавы металлов, применение в промышленности и в быту
Виды металлов, сплавы металлов, применение в промышленности и в быту