Содержание
- 2. Повторение изученного ранее Что такое атом? Что такое ион? Чем отличается ион от атома? Какие типы
- 3. Правила вычисления степени окисления (СО) элементов:
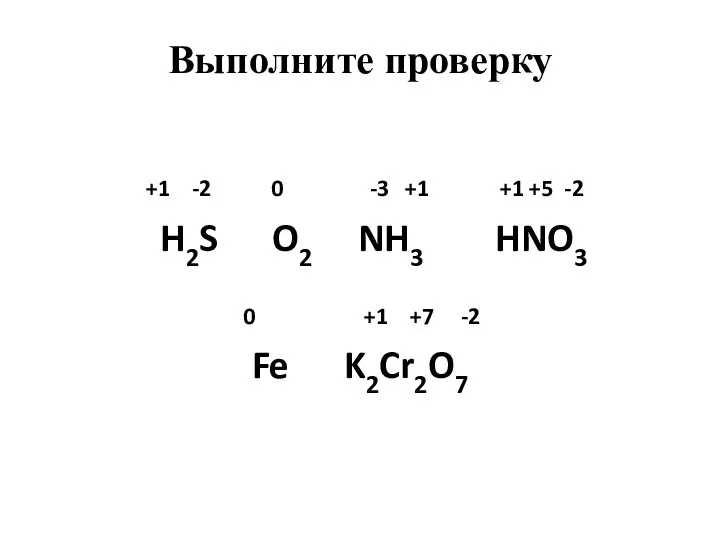
- 4. Определите степени окисления атомов химических элементов по формулам их соединений: H2S, O2, NH3, HNO3, Fe, K2Cr2O7
- 5. +1 -2 0 -3 +1 +1 +5 -2 H2S O2 NH3 HNO3 0 +1 +7 -2
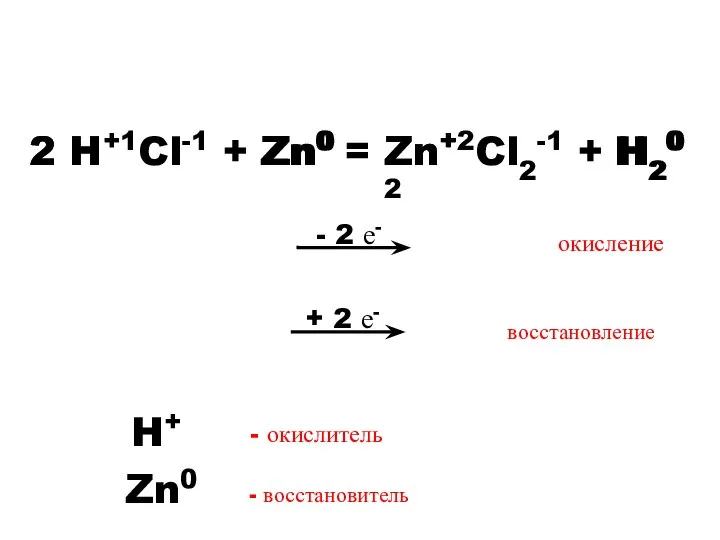
- 6. Расставьте степени окисления элементов в реакциях. Сравните, как ведут себя степени окисления в процессе реакции. HCl
- 7. - 2 е- 2 H+1Cl-1 + Zn0 = Zn+2Cl2-1 + H20 Zn0 2 H+ Zn+2 H20
- 8. Окисление – процесс отдачи электронов. Восстановление – процесс присоединения электронов. Окислитель – элемент, принимающий электроны. Восстановитель
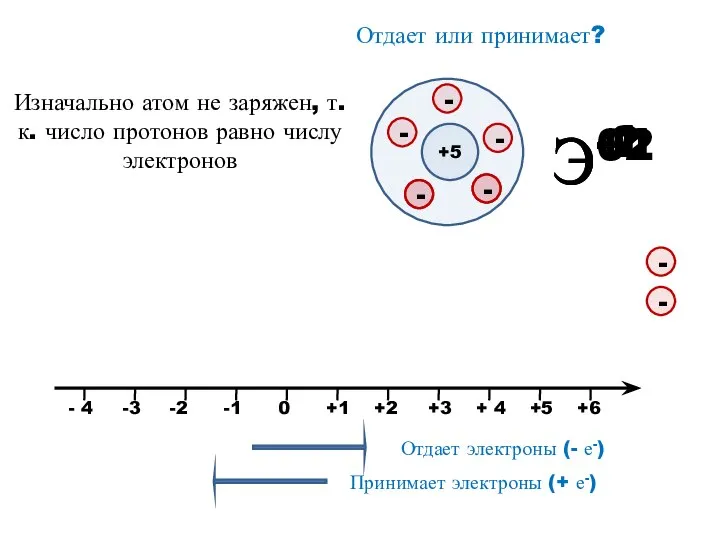
- 9. Э+1 Э+2 Э-2 Э-1 Отдает или принимает? +5 Изначально атом не заряжен, т.к. число протонов равно
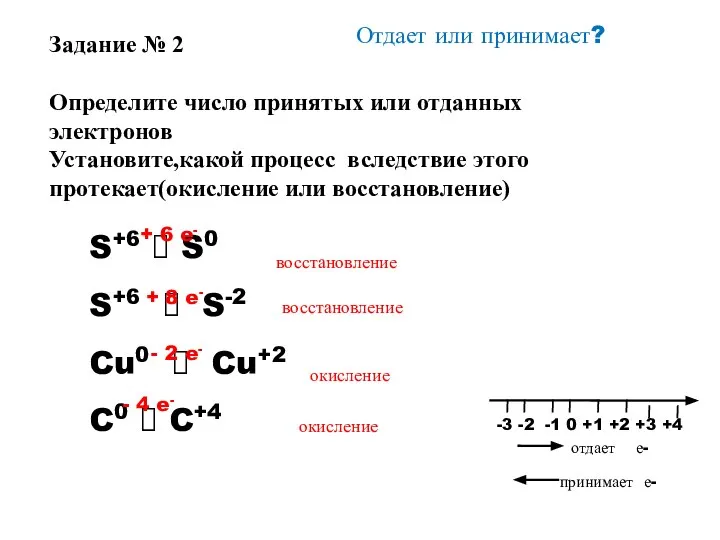
- 10. Отдает или принимает? S+6 ? S0 S+6 ? S-2 Cu0 ? Cu+2 C0 ? C+4 +
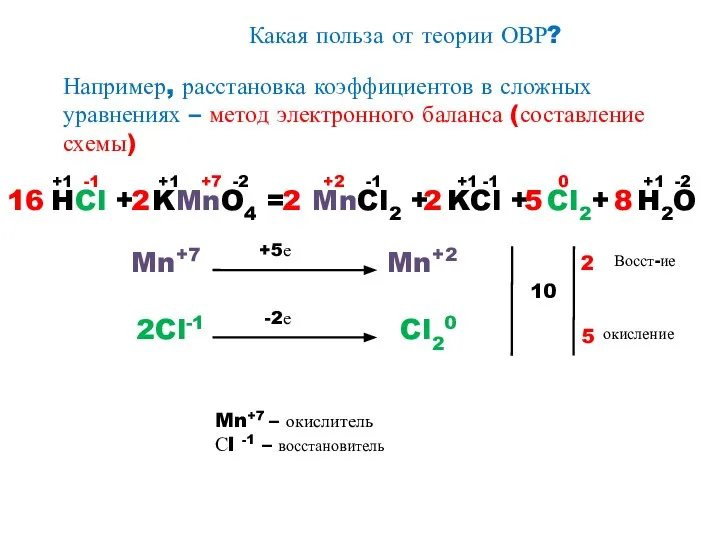
- 11. Какая польза от теории ОВР? Например, расстановка коэффициентов в сложных уравнениях – метод электронного баланса (составление
- 12. Алгоритм составления уравнений ОВР и схемы электронного баланса (записать в тетрадь) 1. Записать схему реакции и
- 13. №2 Нитрат серебра + Медь= AgNO3 + Cu → Cu(NO3)2 + Ag↓ №1 Карбонат кальция+соляная кислота=
- 14. ОВР в быту
- 15. Газ метан горит бесцветным пламенем с образованием воды и углекислого газа СН4+2О2=СО2+2Н2О Горение газа на кухне
- 16. При обработке персолью отбеливание происходит за счет окисления загрязнений 2H2O2=2H2O+O2. Для того чтобы образующийся кислород не
- 17. При взаимодействии железа и кислорода образуется ржавчина. 4Fe+ 2O2= 2Fe2O3 Коррозия металла
- 18. Мы часто сталкиваемся с окислительно-восстановительными реакциями в быту: при горении газа; при коррозии металлов; при отбеливании
- 19. Задание №3 1. Из приведенных схем уравнений реакций выпишите те, которые можно отнести к ОВР 2.
- 21. Скачать презентацию













 Periodická tabuľka prvkov PTP
Periodická tabuľka prvkov PTP ОВ. Структура и принцип работы параметры ОВ
ОВ. Структура и принцип работы параметры ОВ Когда образуется кислая соль?
Когда образуется кислая соль? Презентация на тему Генетическая связь между классами неорганических вещ-в
Презентация на тему Генетическая связь между классами неорганических вещ-в  Легированные стали
Легированные стали Соединения алюминия
Соединения алюминия Ориентация полимеров
Ориентация полимеров Презентация на тему Сплавы металлов (9 класс)
Презентация на тему Сплавы металлов (9 класс)  ліпіди
ліпіди Производство чугуна и стали
Производство чугуна и стали Окислительно-восстановительные реакции, 9 класс
Окислительно-восстановительные реакции, 9 класс Презентация на тему Твердые вещества
Презентация на тему Твердые вещества 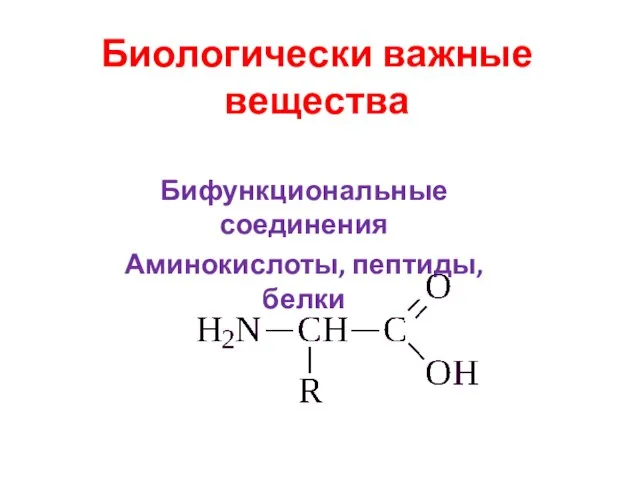 Биологически важные вещества. Бифункциональные соединения. Аминокислоты, пептиды, белки
Биологически важные вещества. Бифункциональные соединения. Аминокислоты, пептиды, белки Химические реакции (игра)
Химические реакции (игра) Физические и фазовые состояния полимеров
Физические и фазовые состояния полимеров Признаки реакции
Признаки реакции ДИЕНОВЫЕ УГЛЕВОДОРОДЫ. КАУЧУКИ.
ДИЕНОВЫЕ УГЛЕВОДОРОДЫ. КАУЧУКИ. Арены. 10 класс
Арены. 10 класс Электролитическая диссоциация
Электролитическая диссоциация Химия – наука о веществах. Вычисления по химическим формулам. Тема 1
Химия – наука о веществах. Вычисления по химическим формулам. Тема 1 Алкины (Ацетилены)
Алкины (Ацетилены) Алкены (этиленовые углеводороды)
Алкены (этиленовые углеводороды) Алканы
Алканы Оксиды в мире минералов
Оксиды в мире минералов Классификация органических соединений
Классификация органических соединений Язык естествознания. Химия
Язык естествознания. Химия Обращеннофазовая хроматография высокого разрешения RP HPLC
Обращеннофазовая хроматография высокого разрешения RP HPLC Химические реакции
Химические реакции