Содержание
- 3. H +1 1 H0 - 1ē → H+1 Восстановительные свойства Окислительные свойства H0 + 1ē →
- 4. Сходства с галогенами: 1. Окислитель в реакциях с металлами: 2Na + H2 = 2NaH t 2.
- 5. Степень окисления + 1 Степень окисления - 1 HF H2O +1 +1 NaH CaH2 -1 -1
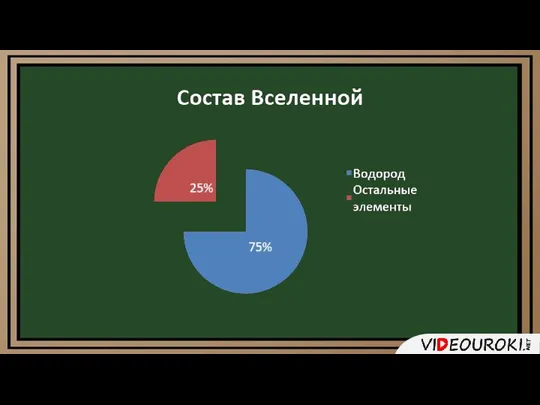
- 8. Водород занимает 9 место по распространенности среди химических элементов. Наиболее важное его соединение – вода. Водород
- 9. Водород – бесцветный нетоксичный газ без запаха и вкуса. Водород в 14,5 раз легче воздуха. M(возд)/M(H2)
- 10. Температура кипения -252,6 0С Температура плавления -259,2 0С Водород незначительно растворяется в воде «гремучий газ»
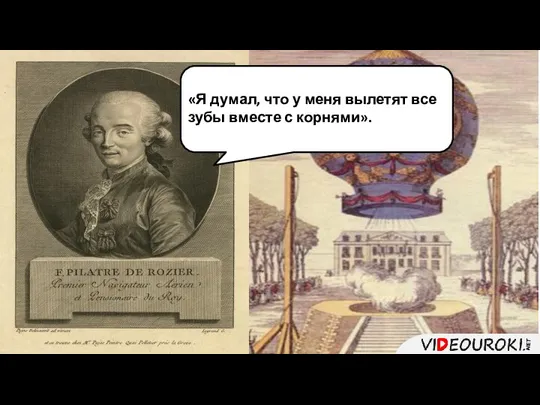
- 11. «Я думал, что у меня вылетят все зубы вместе с корнями».
- 13. Получение водорода: Zn + 2HCl = ZnCl2 + H2↑ а) в лаборатории: б) в промышленности: аппарат
- 15. Водород – восстановитель: t Химические свойства: 2H2 + O2 = 2H2O 0 0 +1 -2 H2
- 16. H2 Производство NH3 Получение HNО3 Получение удобрений Производство HCl Получение CH3OH Получение мыла Производство пластмасс Производство
- 17. Г. Кавендиш Первооткрыватель водорода – Г. Кавендиш. Кавендиш собрал чистый водород. Он получил водород действием серной
- 18. Г. Кавендиш А. Лавуазье Это вещество – газ, а не «горючий воздух». Этот газ – «водород»,
- 19. Водород имеет схожее строение с элементами IA и VIIA групп. Водород проявляет окислительные и восстановительные свойства.
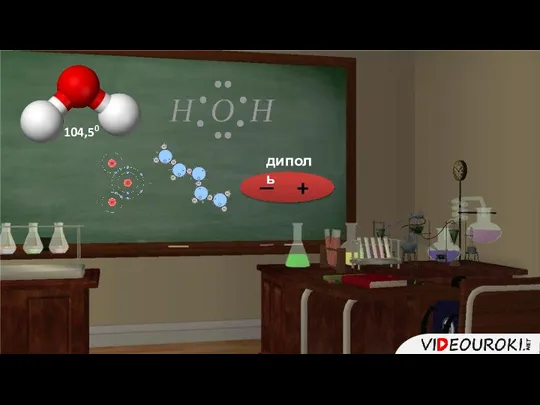
- 20. 104,50 + — диполь
- 21. Водородная связь
- 22. Водородная химическая связь возникает между атомами водорода одной молекулы и атомами наиболее электроотрицательных элементов (фтора, кислорода,
- 23. Твёрдое состояние Жидкое состояние Газообразное состояние
- 24. Вода представляет собой прозрачную жидкость без вкуса и запаха. В тонких слоях она бесцветна, а в
- 25. Вода обладает высокими значениями теплоты плавления и теплоты парообразования. Вода имеет высокую удельную теплоёмкость. Для нагревания
- 26. Плотность воды при н.у. 1 г/см3. Вода обладает высоким поверхностным натяжением.
- 29. Вода обладает вязкостью. Вода – универсальный растворитель. Гидрофильное вещество Гидрофобное вещество Многие соли, спирты, кислоты. Жиры,
- 30. Химические свойства: 6СО2 + 6Н2О = С6Н12О6 + 6О2↑ hν Процесс фотосинтеза Реакции со щелочными металлами
- 31. Химические свойства: Реакции с основными и кислотными оксидами Электролиз воды 0 0 -2 +1 Кислород –
- 32. Химические свойства: Гидролиз Кристаллогидраты Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑ CuSO4 · 5H2O – медный
- 35. Скачать презентацию





























 Презентация на тему Подгруппа кислорода
Презентация на тему Подгруппа кислорода  Сера - химический элемент и простое вещество
Сера - химический элемент и простое вещество Презентация на тему Сложные эфиры
Презентация на тему Сложные эфиры  Презентация на тему Общая характеристика подгруппы углерода
Презентация на тему Общая характеристика подгруппы углерода  Нефть - природный источник углеводородов
Нефть - природный источник углеводородов Белки́ (протеины, полипепти́ды)
Белки́ (протеины, полипепти́ды) Обращеннофазовая хроматография высокого разрешения RP HPLC
Обращеннофазовая хроматография высокого разрешения RP HPLC Алкины: получение и применение
Алкины: получение и применение Презентация на тему Экологические риски при добыче и переработке нефти
Презентация на тему Экологические риски при добыче и переработке нефти  Ковалентная химическая связь
Ковалентная химическая связь Основные понятия химической кинетики. Скорость химической реакции
Основные понятия химической кинетики. Скорость химической реакции Оксиды. Сложные вещества
Оксиды. Сложные вещества Презентация на тему Серная кислота, свойства серной кислоты
Презентация на тему Серная кислота, свойства серной кислоты  Презентация на тему Кристаллические решетки
Презентация на тему Кристаллические решетки  (Bu4N)2[Mo6I8(OOCCH3)6]. Синтез
(Bu4N)2[Mo6I8(OOCCH3)6]. Синтез Магний (Mg, Magnesium). Общая характеристика магния
Магний (Mg, Magnesium). Общая характеристика магния Аналитическая химия (ЛЕКЦИЯ 1)
Аналитическая химия (ЛЕКЦИЯ 1) Материаловедение и технология конструкционных материалов
Материаловедение и технология конструкционных материалов Получение антибиотиков
Получение антибиотиков Строение органических молекул. (Лекция 2)
Строение органических молекул. (Лекция 2) Порох. Сера, халькогены
Порох. Сера, халькогены Первые попытки классификации химических элементов
Первые попытки классификации химических элементов Структура електронної оболонки атома. Енергетичні рівні та підрівні
Структура електронної оболонки атома. Енергетичні рівні та підрівні Строение атома. История открытия
Строение атома. История открытия Закон эквивалентов
Закон эквивалентов Камень, скользящий на льду
Камень, скользящий на льду Спирты или алканолы
Спирты или алканолы Цинк (Zn). Свойства
Цинк (Zn). Свойства