Содержание
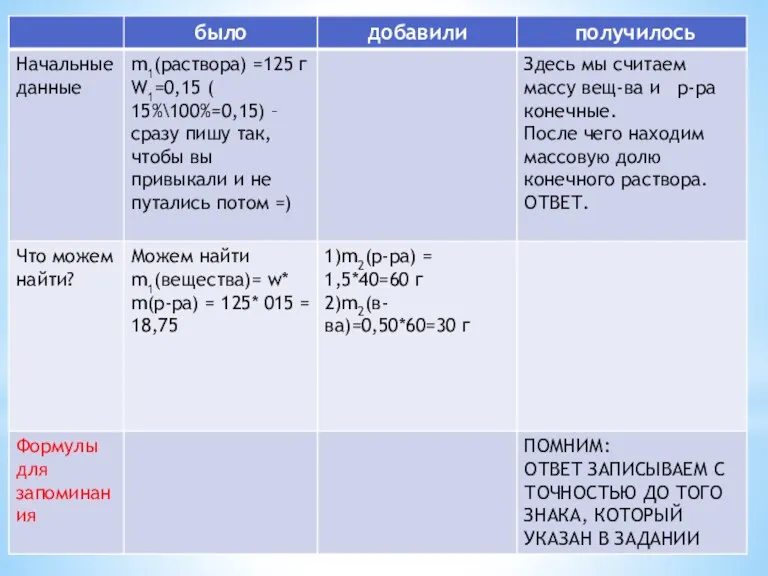
- 2. К 125 г 15%-ной азотной кислоты добавили 40 мл 50 %-ной кислоты (плотность 1,5 г/мл). Вычислите
- 4. Упариванием 1 кг раствора с массовой долей соли 5 % получен раствор с массовой долей соли
- 5. Решение. m1(р-ра)-m2(р-ра)=m(воды)
- 6. Практика Дальше нашла несколько номеров для вашей ПРАКТИКИ. Пожалуйста, попробуйте научиться рассуждать так как старалась я
- 7. Эту задачу разберу в ПН и выложу отдельно на стену группы Вычислите массовую долю сульфата натрия
- 8. Задание 32 1. Продукт (2) взаимодействия фосфида магния с водой (1) сожгли и продукты реакции поглотили
- 9. Рассуждения: Первая реакция фосфида магния с водой, я думаю, что понятна. Рассмотрим подробнее вторую и третью,
- 10. Рассуждения Так вот у второй реакции есть два решения: 2PH3+4O2=P2O5 + 3H2O или 2PH3 + 3O2=
- 11. 1. Ответы (1) Mg3P2 + 6H2O=3Mg(OH)2 + 2PH3 (2)2PH3 +4O2 = P2O5 +3H2O (3)P2O5 +3H2O =
- 12. 2. Медь растворили в разбавленной азотной кислоте(1). К полученному раствору добавили избыток раствора аммиака, наблюдая сначала
- 13. Рассуждения (просто ответы на сл.слайде) Я сразу написала первую реакцию, думаю, что это бы вы тоже
- 14. Ответы
- 15. 3. Раствор иодида калия обработали избытком хлорной воды, при этом наблюдали сначала образование осадка(1), а затем
- 16. Рассуждения: (все реакции на сл.слайде) (1) Мы помним, что активность галогенов изменяется вот так: Cl2>Br2>I2 ,
- 17. Решение
- 18. Практика Дальше нашла несколько номеров для вашей ПРАКТИКИ. Пожалуйста, попробуйте научиться рассуждать так как старалась я
- 19. Продукт взаимодействия азота и лития обработали водой. Выделившийся в результате реакции газ смешали с избытком кислорода
- 21. Две соли окрашивают пламя в фиолетовый цвет. Одна из них бесцветна, и при лёгком нагревании её
- 23. Скачать презентацию

















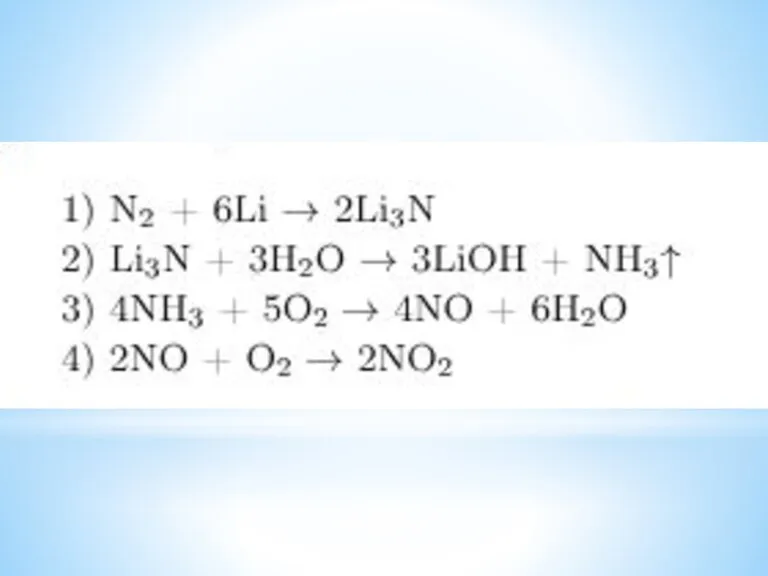

 Самостоятельные работы по разделу Химические реакции в рамках рабочей программы по химии для 8 класса
Самостоятельные работы по разделу Химические реакции в рамках рабочей программы по химии для 8 класса Щелочные металлы
Щелочные металлы Еще раз про электролиз…
Еще раз про электролиз… Химический опыт с горением борноэтилового эфира
Химический опыт с горением борноэтилового эфира Расчетная ячейка при МД моделировании. Граничные условия. Элементарная ячейка для атомов аргона
Расчетная ячейка при МД моделировании. Граничные условия. Элементарная ячейка для атомов аргона Синтез бензотиазин -S,S- диоксидов и тозилцинамонитрилов
Синтез бензотиазин -S,S- диоксидов и тозилцинамонитрилов Химический состав клетки
Химический состав клетки Вывод формул химических веществ
Вывод формул химических веществ Презентация на тему Синтетические моющие средства
Презентация на тему Синтетические моющие средства  MPKh_PREZENTATsIYa_2
MPKh_PREZENTATsIYa_2 Химические и физические явления
Химические и физические явления Первоначальные химические понятия. 2 раунд
Первоначальные химические понятия. 2 раунд Полезные ископаемые
Полезные ископаемые Алюминий. Свойства элементов подгруппы алюминия
Алюминий. Свойства элементов подгруппы алюминия Кислородные соединения азота, азотная кислота. Соли азотной кислоты. Удобрения
Кислородные соединения азота, азотная кислота. Соли азотной кислоты. Удобрения Химическая организация клетки
Химическая организация клетки Использование элементов модульной технологии на уроках химии
Использование элементов модульной технологии на уроках химии Презентация на тему Круговорот углерода в природе
Презентация на тему Круговорот углерода в природе  Чистые вещества и смеси
Чистые вещества и смеси Кинетика химических и биохимических процессов. Часть 1
Кинетика химических и биохимических процессов. Часть 1 Технические материалы. Металлические и неметаллические. (Тема 1)
Технические материалы. Металлические и неметаллические. (Тема 1) Жиры. Классификация
Жиры. Классификация ОГЭ №2, вопрос 1-16
ОГЭ №2, вопрос 1-16 Химические формулы. Относительная молекулярная масса. 8 класс
Химические формулы. Относительная молекулярная масса. 8 класс Типы химических реакций
Типы химических реакций Презентация на тему: Изомерия
Презентация на тему: Изомерия Дополнительный_материал_11.15_23.09.2022_e4f87550
Дополнительный_материал_11.15_23.09.2022_e4f87550 Схема монооксигеназной цепи микросом
Схема монооксигеназной цепи микросом