Содержание
- 2. Буферные растворы За сутки в организме образуется: В пересчете на соляную кислоту; до 20 литров 1
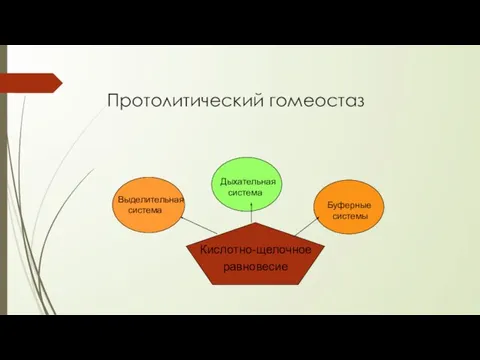
- 3. Протолитический гомеостаз Кислотно-щелочное равновесие Выделительная система Дыхательная система Буферные системы
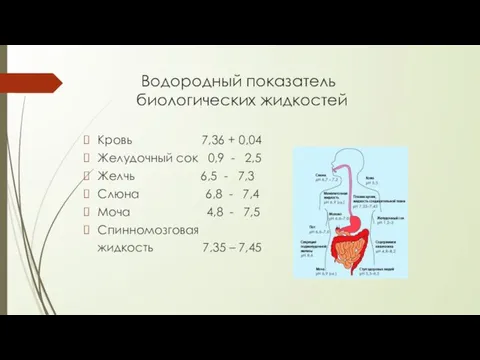
- 5. Водородный показатель биологических жидкостей Кровь 7,36 + 0,04 Желудочный сок 0,9 - 2,5 Желчь 6,5 -
- 6. Показатели кислотно-щелочного равновесия
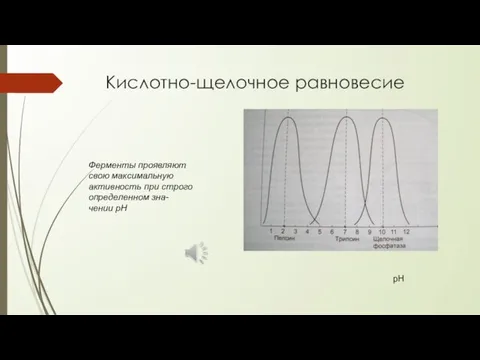
- 7. Кислотно-щелочное равновесие Ферменты проявляют свою максимальную активность при строго определенном зна- чении рН рН
- 8. Биологические буферные системы Основные буферные системы: белковая, гидрокарбонатная, фосфатная Наиболее мощные буферные системы крови: гемоглобиновая, оксигемоглобиновая
- 9. Буферные системы слюны Гидрокарбонатная - 80 % Фосфатная - вторая по значению Белковая
- 10. Буферная емкость слюны Значительно варьируется и может зависеть от следующих факторов: Характер питания Время суток Возраст
- 11. Уровни буферной емкости слюны Тестовые полоски Dentobuffstrip Погружные палочки, импрегнированные (пропитан- ные) кислотой или химическими индикаторами
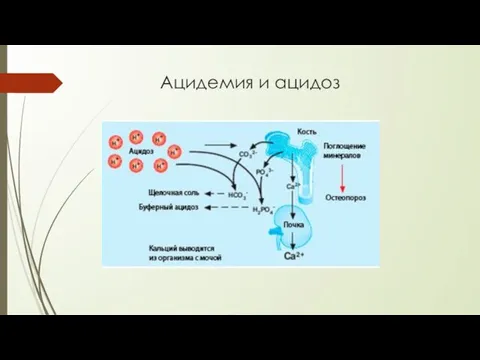
- 12. Ацидемия ( ацидоз ) При сердечно-сосудистых заболеваниях, ишемической болезни, инфаркте миокарда. При тяжелых формах сахарного диабета.
- 13. Ацидемия и ацидоз
- 14. Алкалиемия ( алкалоз ) При потере организмом остатков кислот. При задержке основных катионов. При кишечной непроходимости.
- 15. Белковая буферная система
- 16. Белковая буферная система
- 17. Белковая буферная система
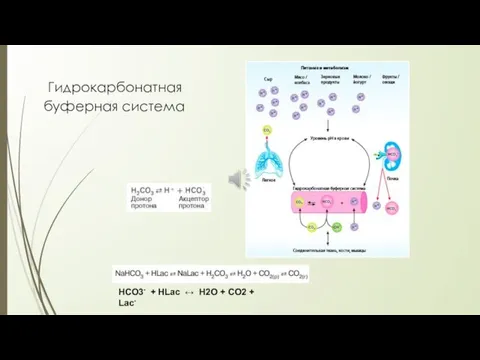
- 18. Гидрокарбонатная буферная система Механизм буферного действия Гидрокарбонатная буферная система: H2CO3 ↔ Н+ + HCO3- кислота NaHCO3
- 19. Гидрокарбонатная буферная система НСО3- + HLac ↔ H2O + CO2 + Lac-
- 20. Гидрокарбонатная буферная система рН = f (СНСО3- , РСО2 ) СНСО-3 = 24,4+3 ммоль/л (зависит от
- 21. Гидрокарбонатная буферная система Метаболический алкалоз Рвота Запор Длительный прием пищи щелочного характера Удаление кислых продуктов Респираторный
- 22. Фосфатная неорганическая буферная система Механизм буферного действия: H3O+ + HPO42 - = H2O + H2PO4- К-та
- 23. Величину рН раствора необходимо поддерживать приблизительно 6,5. Какую буферную систему следует для этого выбрать: ацетатную, фосфатную?
- 24. Гемоглобиновая и оксигемоглобиновая буферные системы рК = 6,95 рК = 8,20 Механизм: Н+ + Нв- =
- 25. Аммиачная буферная система Механизм буферного действия Аммиачная буферная система: NH3×H2O ↔ NН4+ + OH- основание NH4Cl
- 27. Скачать презентацию



















 Технические материалы. Металлические и неметаллические. (Тема 1)
Технические материалы. Металлические и неметаллические. (Тема 1) Очистка белков (Разделение белков из гетерогенной белковой смеси)
Очистка белков (Разделение белков из гетерогенной белковой смеси) Номенклатура алканов разветвленного строения
Номенклатура алканов разветвленного строения Сложные эфиры. Жиры
Сложные эфиры. Жиры Пероксид щелочных металлов
Пероксид щелочных металлов Криогенный разрыв пласта
Криогенный разрыв пласта Дисперсные системы в пищевой промышленности
Дисперсные системы в пищевой промышленности Теория-кинетика
Теория-кинетика Алкины
Алкины Сера и её соединения
Сера и её соединения Электролитическая диссоциация кислот
Электролитическая диссоциация кислот Характеристика переходного элемента на основании его положения в периодической системе Д.И. Менделеева
Характеристика переходного элемента на основании его положения в периодической системе Д.И. Менделеева Металлы. Урок – обобщения
Металлы. Урок – обобщения Презентация на тему Витамин C
Презентация на тему Витамин C  Дисперсные системы
Дисперсные системы Галогены элементы VII – А группы
Галогены элементы VII – А группы Презентация на тему Зеленая химия и проблемы устойчивого развития
Презентация на тему Зеленая химия и проблемы устойчивого развития  Презентация по Химии "Фосфор - элемент жизни и мысли"
Презентация по Химии "Фосфор - элемент жизни и мысли"  Dereglarea metabolismului
Dereglarea metabolismului Презентация на тему Спирты (9 класс)
Презентация на тему Спирты (9 класс)  Типичные ошибки выпускников при решении задач ЕГЭ по органической химии
Типичные ошибки выпускников при решении задач ЕГЭ по органической химии Алюминий. 9 класс
Алюминий. 9 класс Презентация на тему Производство стекла
Презентация на тему Производство стекла  Презентация на тему Электролиз
Презентация на тему Электролиз  Основы общей химии
Основы общей химии Кремний и его соединения
Кремний и его соединения Полупроводники. Германий и кремний
Полупроводники. Германий и кремний Основные физические и химические величины. Элективный курс в 10 классе Решение задач по химии
Основные физические и химические величины. Элективный курс в 10 классе Решение задач по химии