Содержание
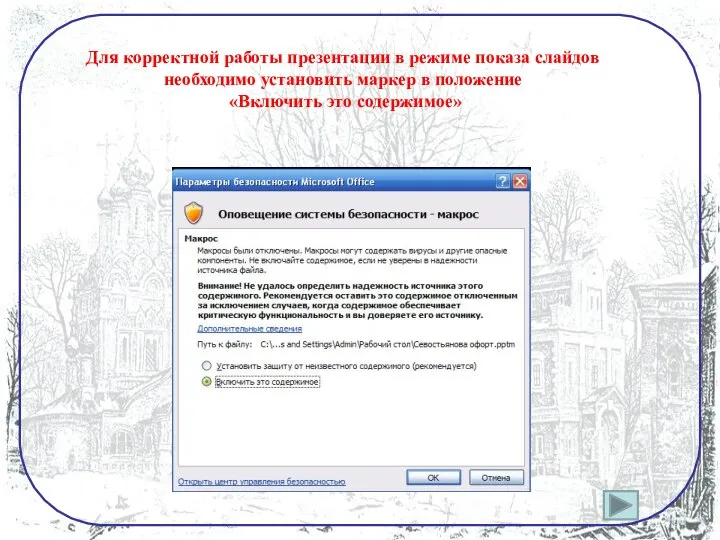
- 2. Для корректной работы презентации в режиме показа слайдов необходимо установить маркер в положение «Включить это содержимое»
- 3. Работы А.П.Остроумовой-Лебедевой А.П. Остроумова -Лебедева, Вид на дворец. Дождь 1923, офорт, Русский музей А.П. Остроумова-Лебедева (1871-1955)
- 4. Гипотеза: В школьном курсе химии очень большое внимание уделяется взаимодействию металлов с кислотами, знание этих реакций
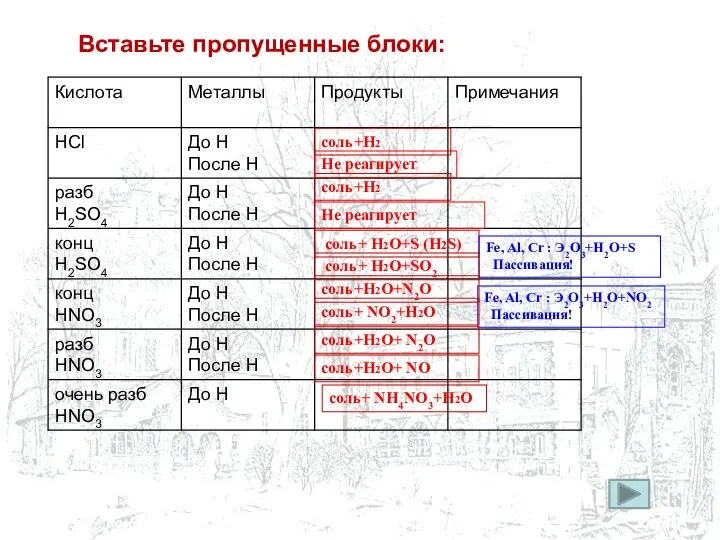
- 5. соль+ Н2O+S (H2S) Не реагирует соль+Н2 Не реагирует соль+Н2 Fe, Al, Cr : Э2O3+H2O+NO2 Пассивация! соль+
- 6. Уравнения химических взаимодействий: Травление алюминиевой пластины соляной кислотой 2Аl + 6 HCl → 2 AlCl3 +
- 8. Скачать презентацию



 Эфиры. 10 класс
Эфиры. 10 класс Взаимное притяжение и отталкивание молекул
Взаимное притяжение и отталкивание молекул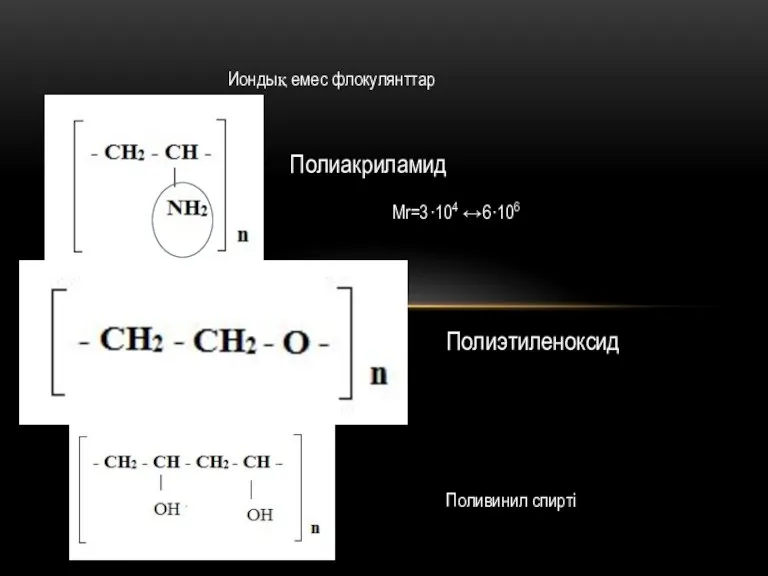 Иондық емес флокулянттар
Иондық емес флокулянттар Электронное строение
Электронное строение Олово и оловоорганические соединения, их свойства и применение
Олово и оловоорганические соединения, их свойства и применение Спирты
Спирты Коррозия металлов
Коррозия металлов Prezentatsia_lektsia_Reaktora_1_Klassifikatsia
Prezentatsia_lektsia_Reaktora_1_Klassifikatsia Органическая химия
Органическая химия Шухов Владимир Григорьевич (1853–1939)
Шухов Владимир Григорьевич (1853–1939) Алкины. Химические свойства
Алкины. Химические свойства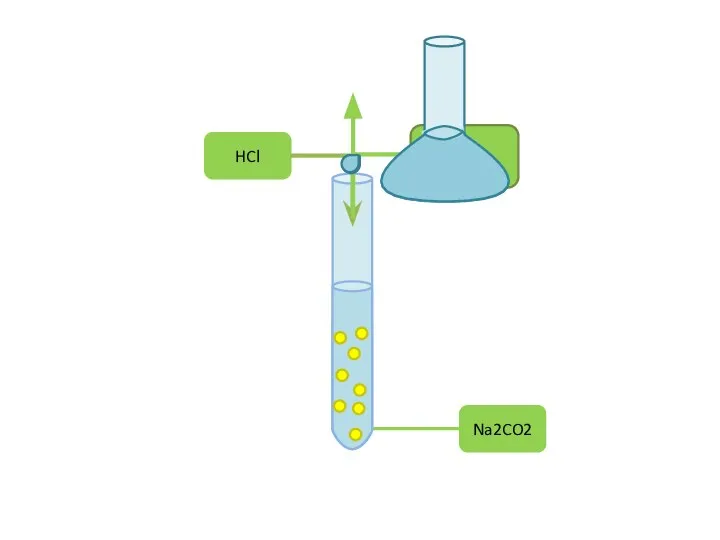 Хімічний експеримент
Хімічний експеримент Физико-химические методы анализа. Лекция 4
Физико-химические методы анализа. Лекция 4 Германий, его характеристика, способы получения органопроизводных, химические свойства. Практическое применение
Германий, его характеристика, способы получения органопроизводных, химические свойства. Практическое применение Экстракция и кристаллизация
Экстракция и кристаллизация Наука Химия на Великой Отечественной войне
Наука Химия на Великой Отечественной войне Характеристика химического элемента-неметалла на основании его положения в ПСХЭ Д.И.Менделеева. 9 класс
Характеристика химического элемента-неметалла на основании его положения в ПСХЭ Д.И.Менделеева. 9 класс Применение личностно-ориентированного подхода в обучении химии
Применение личностно-ориентированного подхода в обучении химии Природные источники углеводородов
Природные источники углеводородов Комплексонометрическое титрование. Часть 2. Лекция 6
Комплексонометрическое титрование. Часть 2. Лекция 6 Презентация на тему Галогены и их соединения
Презентация на тему Галогены и их соединения  Липиды
Липиды Алканы
Алканы Химия в загадках
Химия в загадках Магний (Mg, Magnesium). Общая характеристика магния
Магний (Mg, Magnesium). Общая характеристика магния Особенности строения вещества. Лекция №2. Строение кристаллов
Особенности строения вещества. Лекция №2. Строение кристаллов Бериллий, магний и щелечноземельные металлы
Бериллий, магний и щелечноземельные металлы Материалы к уроку «Значение растворов» Автор: учитель СОШ № 4 Чурбакова Елена Васильевна
Материалы к уроку «Значение растворов» Автор: учитель СОШ № 4 Чурбакова Елена Васильевна